Le tableau périodique est le plus important moyen de comparaison entre les éléments chimiques.
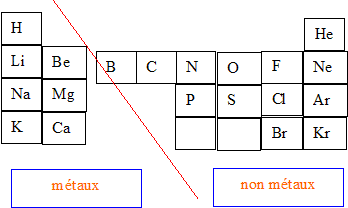
Les , les plus nombreux occupent la partie gauche du tableau; les non-métaux, moins nombreux, ocuppent la partie droite.
Ce classement montre le lien entre propriétés chimiques et la structure atomique.
Il permet de prévoir la formule des composés et le type de liaison au sein d'une molécule.
Les éléments chimiques sont classés par ordre de leur numéro atomique.
Les lignes horizontales constituent des .
Les colonnes verticales forment des .
Les éléments d'une même famille ont la même structure électronique et des propriétés semblables.
L' n'appartient à aucune famille chimique: il se comporte comme un métal alcalin, et parfois comme un halogène.
Les métaux constituent la première colonne ( Na, Li, K...). Leur couche électronique externe compte un électron ; celui-ci est facilement perdu et on obtient des possédant une charge positive.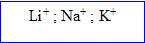
Les métaux alcalino- constituent la seconde famille ( Be, Mg, Ca). Leur couche électronique externe compte électrons ; ces derniers sont facilement perdus et on obtient des cations portant deux charges positives. 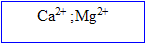
Les éléments de la famille du carbone comptent électrons externes et mettent en oeuvre 4 liaisons de covalence.
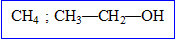
Les éléments de la famille de l'azote comptent électrons externes et donnent essentiellement 8-5= liaisons de covalence.
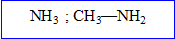
Les éléments de la famille de l'oxygène comptent électrons externes et donnent :
- soit des avec deux charges négatives 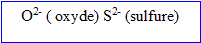
- soit mettent en oeuvre 8-6= liaisons de covalence 
Les éléments de la famille des ( F ; Cl, Br) comptent électrons externes et donnent :
- soit des ions négatifs avec une charge néagtive
- soit mettent en oeuvre 8-7 = 1 liaison de covalence 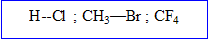
Les éléments de la dernière colonne constituent la famille des gaz . Possédant une structure électronique externe saturée à électrons, leur réactivité chimique est très faible.