L’eau de Javel est une solution aqueuse d’hypochlorite de sodium (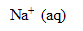 +
+ 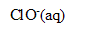 ) et de chlorure de sodium (
) et de chlorure de sodium (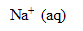 +
+ 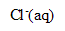 ) en milieu basique.
) en milieu basique.
Elle est préparée par réaction directe entre le dichlore et la solution aqueuse d’hydroxyde de sodium. Cela correspond à la dismutation du dichlore ; le dichlore est à la fois réduit et oxydé.
Les couples en jeu sont : 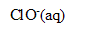 /
/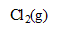 et
et 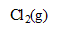 /
/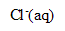 .
.
1. Etablir, en milieu basique, les demi-équations électroniques des réactions intervenant lors de la dismutation du dichlore.
Le dichlore joue le rôle de réducteur : il s' et cède des électrons
Le dichlore joue le rôle d'oxydant : il se
et gagne des électrons
2. Ecrire l'équation chimique modélisant la préparation de l’eau de Javel.
3. La composition de l’eau de Javel dépend du pH. On a, dans l'eau, les équilibres suivants :
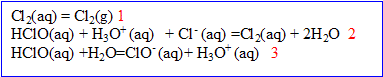
- Quelle est la nature de la réaction (2). Justifier.
La réaction (2) est une réaction d’oxydo-réduction : il y a échange d’
, oxydation des ions chlorure (couple
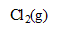
/
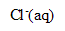
) et réduction de l’acide hypochloreux (couple HClO(aq)/
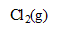
).
-Quelle est la nature de la réaction (3). Justifier.
La réaction (3) est une réaction acido-basique : il y a échange de
entre les couples HClO(aq)/
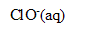
et
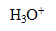
/
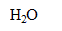
.
4. On donne, ci-dessous, un diagramme de distribution des espèces en fonction du pH.
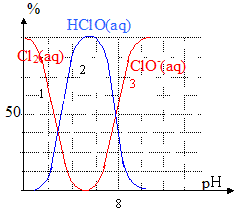
- Déterminer la constante d’équilibre K de la réaction (3). Conclure.
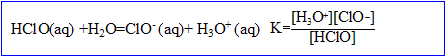
Lorsque [
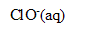
] = [HClO(aq)],alors pH = pK.
L’égalité des concentrations des espèces conjuguées (intersection des courbes 2 et 3) est obtenue à pH voisin 7,5.
Soit : pK =
. K = 10 exposant -7,5 voisin de 3,2 10 exposant-8
La constante d’équilibre étant très faible, la réaction est très
.
- En utilisant les trois équations proposées et le diagramme de distribution des espèces, expliquer ce qui se passe lorsqu’on ajoute progressivement de l’acide chlorhydrique concentré dans de l’eau de Javel.
En ajoutant progressivement de l’acide chlorhydrique dans l’eau de Javel, le pH
. L’équilibre précédent est déplacé dans le sens
, la formation de l’acide hypochloreux. Lorsque le pH devient inférieur à 5, une autre réaction a lieu, il se forme du
, d’abord solvaté. Lorsque la limite de solubilité est atteinte, l’équilibre (1) a lieu : du dichlore se dégage.
5. En milieu basique, l’ion hypochlorite réagit lentement avec l’eau selon la réaction (4):
2
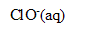
= 2
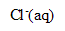
+
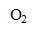
- Quels sont les paramètres susceptibles d’accélérer la réaction de décomposition de l’ion hypochlorite ?
La
et la concentration de l’eau de Javel en ions hypochlorite accélèrent la décomposition de l'eau de Javel.
- En déduire le mode de stockage de l’eau de Javel le plus approprié.
Les solutions stockées doivent être des solutions
d’eau de Javel (éviter le stockage sous la forme de berlingots), placées dans un endroit frais.