Pierre trouve dans le placard du laboratoire de chimie une bouteille, sans étiquette, contenent une solution brune. Il décide d'y coller une étiquette portant le nom de la solution ainsi que sa concentration en soluté apporté.
1. Comment peut il procéder pour vérifier simplement si la solution est ionique ?
Une solution contenant des conduit le courant électrique. Mesurer sa (celle-ci est d'autant plus grande que la solution est plus conductrice)
2. Il introduit un peu de la solution dans deux tubes à essais : dans le premier, il ajoute quelques gouttes d'une solution d'hydroxyde de sodium et observe la formation d'un précipiré rouille ; dans le second, il verse quelques gouttes d'une solution de nitrate d'argent et observe un précipité blanc. Tous les autres tests qu'il effectue restent négatifs.Quels sont les ions contenus dans la solution ?
Le précipité rouille ( hydroxyde de fer III ) indique la présence de l'ion III.
Le précipité blanc( chlorure d'argent) indique la présence de l'ion . 
- Quel est le nom de cette solution ?
chlorure de fer III
- A partir de quel solide ionique cette solution a t'elle été préparée ?
chlorure de fer III
- Ecrire l'équation de réaction modélisant la dissolution de ce solide
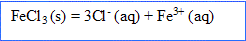
La solution ( comme le solide ionique) reste électriquemlent : donc 3 ions chlorure pour un ion fer III.
3. Pierre a pu déterminer, par une technique appropriée, la concentration effective des ions qu'il a identifié par addition de la solution de nitrate d'argent. Elle est égale à 2,5 x 10 exposant -3 mol/L.
- Déterminer la concentration C en soluté apporté de cette solution.
D'après les coefficients stoechiomètriques de l'équation ci-dessus : 2,5 10 exposant -3 par 3 soit C= 8,3 10 exposant-4 mol/L
- Calculer la concentration effective de l'autre ion contenu dans la solution.
D'après les coefficients stoechiomètriques de l'équation ci-dessus : [ion fer III] = C= 8,3 10 exposant-4 mol/L