1. L'éthanoate de sodium 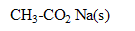 ( M=82 g/mol) se dissout dans l'eau donnant une solution (S)constituée d'ions sodium et d'anions. Quelle est la formule des anions appelés ions éthanoate ?
( M=82 g/mol) se dissout dans l'eau donnant une solution (S)constituée d'ions sodium et d'anions. Quelle est la formule des anions appelés ions éthanoate ?
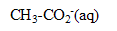
2. On dissout 4,1 g d'éthanoate de sodium dans 0,50 L d'eau. Le pH de la solution obtenue est égal à 8,9. Que peut on en déduire concernant l'éthanoate de sodium ?
Le pH est supérieur à 7 : le milieu est . L'ion éthanoate est une .
3. L'anion en solution est la forme basique d'un couple acide/base. Déterminer la formule de sa forme acide conjuguée et écrire la demi-équation liant ces deux formes.
acide conjugué : acide 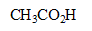
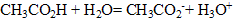
4. On ajoute 0,40 L d'acide chlorhydrique de concentration c= 0,20 mol/L à la solution S. Comment évolue le pH de la solution ?
Le pH de la solution va .
5. Ecrire l'équation chimique de la réaction qui a lieu.
L'acide chlorhydrique apporte des ions 
Les couples acide base mis en présence sont :
 /
/ 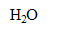
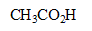 /
/ 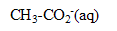
l'ion oxonium, acide, réagit avec la base, ion éthanoate :
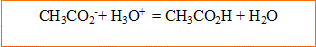
6. Au cours de cette réaction, une entité chimique a été transférée. Laquelle ?
Il y a transfert d'un 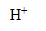 de l'ion oxonium à l'ion éthanoate.
de l'ion oxonium à l'ion éthanoate.
7. Vérifier l'électroneutralié de la solution.
La solution déthanoate de sodium contient des ions éthanoate et des ions sodium telle que :
Quantité de matière initiale en ion sodium égale quantité de matière initiale en ion éthanoate = masse du solide (g) / masse molaire (g)mol)= 4,1/82 = mol.
Volume total du mélange : 0,5+0,4 = L
concentration finale en ion sodium : 0,05/0,9 = mol/L
La solution d'acide chlorhydrique contient des ions oxonium et des ions chlorure telle que:
Quantité de matière initiale en ion oxonium = quantité de matière initiale en ion chlorure = 0,2*0,4 = mol.
concentration finale en ion chlorure : 0,08/0,9 = mol/L
| avancement (mol) | 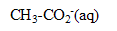 | + | =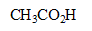 | +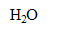 |
| initial | 0 | 0,05 | 0,08 | 0 | solvant |
| en cours | X | 0,05-X | 0,08-X | X | en grande |
| fin | Xf | 0,05-Xf | 0,08-Xf | Xf | quantité |
| fin | Xf=0,05 | 0 | 0,03 | 0,05 | |
Quantité de matière finale ion oxonium : 0,03 mol dans 0,9 L
concentration ion oxonium : 0,03/0,9 =
mol/L
On peut constater que : [ion oxonium] + [ion sodium]=[ion chlorure]
en effet : 0,033+0,056 = 0,089 mol/L