|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||
| .
. |
||
|
||
|
|
Toutes les solutions sont prises à 25 °C. A Le sulfure d'hydrogène est un diacide.
B Un échantillon de 3 g de déchets métalliques contenant 5 % de nickel et 15 % de fer (% en masse) est mis à réagir avec un acide fort qui fait passer ces éléments en solution à l'état d'ions Ni2+ et Fe2+. Le volume de la solution est ajusté à 250 mL avec de l'eau déminéralisée. Soit S la solution obtenue :
Constantes d’acidité pKa1 : H2S/HS- 7,00 ; pKa2 : HS-/S2- 12,90 Constantes de solubilité pKs : NiS 25,0 ; FeS 18,4 ; Ni(OH)2 16,0 M Fe = 56 g.mol-1 M Ni = 58,7 g.mol-1. corrigé 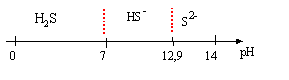
pH d'une solution de sulfure d'hydrogène de concentration 5 10-2 mol.L–1. H2S+H2O=HS-+H3O+ ; ka1 = [HS-][H3O+]/[H2S] (1) HS- +H2O=S2-+H3O+ ; ka2 = [S2-][H3O+]/[HS-] (2) conservation de l'élément soufre : 5 10-2 = [H2S]+[HS-]+[S2-] (3) solution électriquement neutre : [HS-]+2[S2-] +[HO-]= [H3O+] (4) hypothèse 1 : milieu acide donc [HO-] et [S2-] négligeables devant les concentrations des autres espèces. (3) s'écrit alors : 5 10-2 = [H2S]+[HS-] avec [H2S] = [HS-][H3O+] / ka1. 5 10-2 = [HS-][H3O+] / ka1 +[HS-] (4) s'écrit alors : [HS-]= [H3O+] d'où : 5 10-2 = [H3O+]² / ka1+ [H3O+] et en notant [H3O+]=h 5 10-2 = h² / ka1+ h ; 5 10-2 = 107h² + h ; 107h² + h -5 10-2 = 0 La résolution donne : h= 7,07 10-5 mol/L soit pH= 4,15. l'hypothèse faite est bien vérifiée. Relation liant la concentration en ions sulfure à la concentration en ions H3O+ et à la concentration en H2S : (1) s'écrit : [HS-]= ka1[H2S]/[H3O+] repport dans (2) : ka2 = [S2-][H3O+]²/( ka1[H2S]) ; [H2S]= [S2-][H3O+]²/( ka1ka2 ) (2) s'écrit : [HS-] = [S2-][H3O+]/ ka2 repport dans (3) : 5 10-2 = [S2-][H3O+]²/( ka1ka2 ) + [S2-][H3O+]/ ka2 + [S2-] 5 10-2 = [S2-] ( 1 + [H3O+]/ ka2 +[H3O+]²/( ka1ka2 ) ) 5 10-2 = [S2-] ( 1 + h/ ka2 +h²/( ka1ka2 ) ) [S2-] =5 10-2 /(1 + h/ ka2 +h²/( ka1ka2 )) [S2-] =5 10-2 /( 1+ 1012,9h + 1019,9 h²) Concentration en Ni2+ et Fe2+ de la solution S : masses : 3*0,15 = 0,45 g fer et 3*0,05 = 0,15 g nickel Qté de matière (mol) =masse (g) / masse molaire(g/mol) nNi= 0,15 / 58,7 = 2,55 10-3 mol ; nFe= 0,45 / 56 = 8,03 10-3 mol concentration(mol/L) = Qté de matière (mol) / volume solution (L) [Ni2+]= 2,55 10-3
/0,25 = 1,02 10-2 mol/L ; [Fe2+]=
8,03 10-3 /0,25 = 3,21 10-2
mol/L
NiS précipite dès que son produit de solubilité est atteint : 10-25 =[Ni2+][S2-] donc dès que [S2-] =10-25 / 1,02 10-2 = 9,8 10-24 mol/L FeS précipite dès que son produit de solubilité est atteint : 10-18,4 =[Fe2+][S2-] donc dès que [S2-] =10-18,4 / 3,21 10-2 = 1,24 10-17 mol/L Ni(OH)2 précipite dès que son produit de solubilité est atteint : 10-16 = [Ni2+][HO-]2 donc dès que [HO-] =( 10-16 / 1,02 10-2 )0,5 = 9,9 10-8 mol/L soit à partir de pH = 7 Quelle est la valeur de [S2-] à pH=7 ? [S2-] =5 10-2 /( 1+ 1012,9h + 1019,9 h²) = 5 10-2 /( 1+ 105,9 + 105,9 ) =3,1 10-8 mol/L. en conséquence NiS précipite le premier.
FeS précipite donc dès que [S2-] = 1,24 10-17 mol/L or [S2-] =5 10-2 /( 1+ 1012,9h + 1019,9 h²) 1,24 10-17 ( 1+ 1012,9h + 1019,9 h²) = 5 10-2. 1+ 1012,9h + 1019,9 h² = 4 1015. 1019,9 h² +1012,9h
- 4 1015=0 ; la résolution donne pH=2,15.
[Ni2+]fin = 1,02 10-2 *0,001=1,02 10-5 mol/L 10-25 =[Ni2+]fin[S2-]fin ; [S2-]fin =10-25 / 1,02 10-5 = 9,8 10-21 mol/L [S2-] =5 10-2 /( 1+ 1012,9h + 1019,9 h²) 9,8 10-21=5 10-2 /( 1+ 1012,9h + 1019,9 h²) 9,8 10-21( 1+ 1012,9h + 1019,9 h²) =5 10-2 1+ 1012,9h + 1019,9 h² = 5,1 1018. 1019,9 h² + 1012,9h -5,1 1018=0 la résolution donne : pH=0,6. Dans le domainre de pH [0,6 ; 2,15] NiS précipite, alors que le sulfure de fer ne précipite pas.
|
|
corrigé 
pH d'une solution de sulfure d'hydrogène de concentration 0,1 mol.L–1. H2S+H2O=HS-+H3O+ ; ka1 = [HS-][H3O+]/[H2S] (1) HS- +H2O=S2-+H3O+ ; ka2 = [S2-][H3O+]/[HS-] (2) conservation de l'élément soufre : 0,1 = [H2S]+[HS-]+[S2-] (3) solution électriquement neutre : [HS-]+2[S2-] +[HO-]= [H3O+] (4) hypothèse 1 : milieu acide donc [HO-] et [S2-] négligeables devant les concentrations des autres espèces. (3) s'écrit alors : 0,1 = [H2S]+[HS-] avec [H2S] = [HS-][H3O+] / ka1. 0,1 = [HS-][H3O+] / ka1 +[HS-] (4) s'écrit alors : [HS-]= [H3O+] d'où : 0,1 = [H3O+]² / ka1+ [H3O+] et en notant [H3O+]=h 0,1 = h² / ka1+ h ; 0,1 = 107h² + h ; 107h² + h -0,1 = 0 La résolution donne : h= 9,995 10-5 mol/L soit pH= 4. l'hypothèse faite est bien vérifiée. [HS-]= [H3O+] =9,995 10-5 mol/L ; [HO-]=10-14/9,995 10-5 =10-10 mol/L [H2S] = [HS-][H3O+]/ka1 =(9,995 10-5)/ 10-7= 9,99 10-2 mol/L ka2 = [S2-][H3O+]/[HS-] donne ka2 = [S2-] = 10-12,9 mol/L 10-22,8 = [Zn2+][S2-] avec[Zn2+]initial =0,01 mol le sulfure de zinc précipite dès que [S2-] =10-22,8 /0,01 = 10-20,8 mol/L Or d'après la question précédente [S2-] = 10-12,9 mol/L, donc une partie ou la totalité des ions zinc précipitent. Domaine de pH : [Zn2+]fin = 10-2 *0,001= 10-5 mol/L 10-22,8 =[Zn2+]fin[S2-]fin ; [S2-]fin =10-22,8 / 10-5 = 1,58 10-18 mol/L D'après l'exercice 1 ci-dessus : [S2-] =0,1 /( 1+ 1012,9h + 1019,9 h²) 1,58 10-18=0,1 /( 1+ 1012,9h + 1019,9 h²) 1,58 10-18 ( 1+ 1012,9h + 1019,9 h²) =0,1 1+ 1012,9h + 1019,9 h² = 6,3 1016. 1019,9 h² + 1012,9h -6,3 1016=0 la résolution donne : pH=1,55. 99,9 % des ions zinc précipitent pour un pH supérieur ou égal à 1,55. En conséquence à pH =4, 99,9% des ions Zn2+ se trouvent sous forme de ZnS ( réponse à la question précédente) quantité de sulfure de zinc qui se dissout à pH=10. à pH=10 l'ion HS- prédomine. La concentration totale des espèces soufrées est égale à la concentration en ion zinc ; il faut chercher les concentrations [H2S], [HS-], [S2-] sachant que [H3O+]=10-10 mol/L H2S+H2O=HS-+H3O+ ; ka1 = [HS-][H3O+]/[H2S] ; [HS-] /[H2S] =ka1/[H3O+] = 10-7/10-10 = 1000 [HS-] /[H2S]= 103 (1) HS- +H2O=S2-+H3O+ ; ka2 = [S2-][H3O+]/[HS-] ; [S2-]/[HS-]= ka2 /[H3O+]= 10-12,9/10-10 = 10-2,9 =1,26 10-3. [S2-]/[HS-] =1,26 10-3 ou bien [HS-]/ [S2-] = 7,94 102. (2) conservation de l'élément soufre en solution : C = [H2S]+[HS-]+[S2-] (3) or ZnS (s) = S2- + Zn2+. la concentration totale des espèces soufrées est égale à la concentration en ion zinc (3) s'écrit : [H2S]+[HS-]+[S2-] = [Zn2+] hypothèse 1 : à pH=10 , [H2S] est négligeable devant les autres concentrations (3) devient : [HS-]+[S2-] = [Zn2+] ; [S2-] ( [HS-]/[S2-]+1)= [Zn2+] [S2-] *7,94 102 = [Zn2+] ; [S2-] = [Zn2+]/7,94 102 de plus le produit de solubilité conduit à : 10-22,8 =[Zn2+][S2-] 10-22,8 =[Zn2+]2/7,94 102 ; [Zn2+]2 = 10-22,8*7,94 102 = 1,26 10-20 ; [Zn2+] = 1,12 10-10 mol/L. l'hypothèse est-elle bien vérifiée ? [S2-] = 10-22,8 /[Zn2+] = 1,41 10-13 mol/L ; [HS-] = 794*[S2-] = 1,12 10-10 mol/L ; [H2S]= [HS-] / 103 =1,12 10-13 mol/L ; [H2S] comme [S2-] sont bien négligeables devant [HS-]
|
||
|
|