|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||
| .
. |
|||||||||||||||||||
|
|||||||||||||||||||
|
|
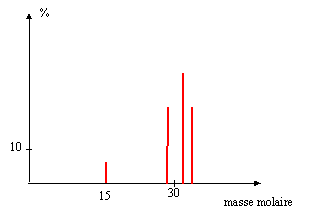
Soit un spectromètre de masse. Une substance organique est introduite dans la chambre d'ionisation où elle donne les fragments F1+, F2+, F3+ et F4+ de masse m1, m2, m3 et m4 respectivement.
|
||||||||||||||||||
|
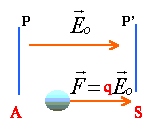
travail de cette force = qUAS' la charge étant positive, le potentiel de S doit être plus petit que celui de A. (UAS positive) Le champ électrique est dirigé vers les plus petits potentiels.
La variation d'énergie cinétique entre A et S est égale au travail de la force électrique. L'énergie cinétique initiale est voisine de zéro. 0,5mv² = qUAS de même pour l'ion de masse mi : 0,5mivi² = qUAS v² =2qUAS/m
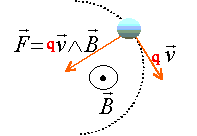
La force magnétique est constamment perpendiculaire à la vitesse : en conséquence cette force ne travaille pas. L'énergie cinétique ne varie pas et la norme de la vitesse est constante : mouvement uniforme. la trajectoire est contenue dans le plan défini par la vitesse et la force. La force est centripète. Ecrire la seconde loi de Newton dans la base de Frenet suivant la normale : qvB = mv²/ R soit R = mv/ (qB) ; B= mv/(qR) or v = (2qUAS/m)½ d'où B = (2mUAS/(qR²))½ . Calcul de m1 si B1 = 0,177 T : B² = 2mUAS/(qR²) ; m1 = q1 R1²B1²/ (2UAS) q1 =1,6 10-19 C ; R1 = 0,2 m ; B1 =0,177 T ; UAS = 4 000 V m1 =1,6 10-19* 0,22 * 0,1772 / 8000 = 2,5 10-26 kg. masse molaire = m1 NA= 2,5 10-26 * 6,02 1023 = 1,5 10-2 kg/mol = 15 g/mol. composition molaire du mélange : Chaque fragment porte une charge élémentaire : en divisant la charge collectée durant la durée D t par la charge élémentaire on trouve le nombre de chaque fragment collecté.
|
|||||||||||||||||||
|
|