|
durée (3 heures) Chimie : d'après concours externe technicien police scientifique 2001 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
|
|
Dans un ballon bicol de 250 mL, on introduit environ 20
mL de soude à 1 mol/L ; puis V= 2 mL de benzaldehyde et, enfin,
quelques grains de pierre ponce. On adapte un réfrigérant à reflux et
une ampoule de coulée, dans laquelle on verse V1 = 60 mL de
solution de permanganate de potassium à c1 = 0,25 mol/L. A
l'aide d'un chauffe ballon placé sur un plateau à crémaillère, on porte
le mélange réactionnel à éullition douce, puis on ajoute goutte à
goutte la solution oxydante. Pour réduire le permanganate de potassium en excès, on ajoute quelques gouttes d'éthanol jusqu'à disparition de la teinte violette de la phase liquide. On retire le ballon du chauffe ballon tout en maintenant le reflux. Après refroidissement, on filtre le mélange sur büchner : le filtrat est limpide. On le verse alors dans un erlenmeyer contenant 10 mL d'acide chlorhydrique à 5 mol/L. L'acide benzoïque précipite : on place l'erlenmeyer dans un bain eau glace pour favoriser la précipitation. On filtre sur büchner ; le solide blanc est rincé, puis séché à l'étuve. Une fois sec, il est pesé ; on trouve m= 1,94 g. Données : masse volumique de l'acide benzoïque r= 1,04 g/mL. solubilité dans l'eau : - de l'acide benzoïque : 2,4 g/L à 20°C et 68 g/L à 95°C. potentiel standart redox : E°(MnO4-/MnO2)= 1,69 V ; E°(MnO4-/MnO42-)= 0,58 V; E°(C6H5COOH/C6H5CHO)= -0,1 V ; E°(CH3COOH/C2H5OH)= 0,05 V ;
corrigé
2 fois { MnO4-
+ 3e- + 2H2O = MnO2 + 4 HO-
} réduction .
C6H5CHO + 3HO- = C6H5COO- + 2e- + 2H2O oxydation 3 MnO4- + C6H5CHO + 3HO- = C6H5COO- + 3 MnO42- + 2H2O oxydoréduction l'ion manganate MnO42- n'est pas stable ; il se dismute : 3 MnO42- + 2 H2O ---> 2MnO4- +MnO2(solide) + 4 OH- il n'est pas génant dans la synthèse. réduction excès ion permanganate : 4 fois{ MnO4- + 3e- + 2H2O = MnO2 + 4 HO- }( réduction) 3 fois{ CH3CH2OH + 5 HO- = CH3COO- + 4e- + 4H2O } ( oxydation) 4 MnO4- + 3 CH3CH2OH --> 4 MnO2 + 3CH3COO- + 4 H2O +HO- l'ion acétate (éthanoate ) est une base : elle va réagir avec l'acide chlorhydrique ajouté pour donner l'acide éthanoïque , soluble dans l'eau alors que l'acide benzoïque formé est quasiment insoluble dans l'eau à 20°. cet ion acétate n'est pas génant
d'autant plus qu'il n' est ni oxydant ni réducteur dans ces conditions.
en présence d'acide chlorhydrique l'ion benzoate, soluble dans l'eau conduit à l'acide benzoïque C6H5 COO- + H3O+ -->C6H5 COOH + H2O réaction acide base. l'acide benzoïque est d'autant moins soluble dans l'eau que la température est plus basse. rendement = masse réelle / masse théorique calculée à partir de 19,6 mmol de benzaldehyde on peut théoriquement obtenir 19,6 mmol d'acide benzoïque masse molaire C6H5 COOH : 7*12+6+32 = 122 g/mol masse théorique : 122 *0,0196 = 2,39 g rendement = 1,94 / 2,39 = 0,81. (81%)
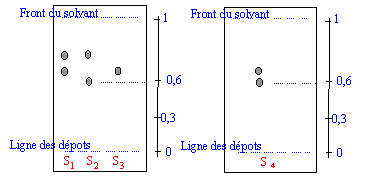
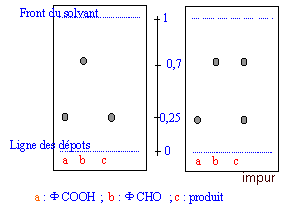
Une chromatographie sur couche mince permet d'identifier et de séparer les constituants d'un mélange en jouant sur la différence de solubilité d'une substance entre un support fixe et une phase mobile ( l'éluant). le révélateur ( ici rayons UV) permet de rendre visible des taches initialement incolores. L'acide benzoïque et le benzaldehyde possédant un noyau benzénique peuvent absorbés les rayons UV. Sur la plaque CCM sensible aux UV on observera donc des taches sombres ( en éclairant avec une lampe UV) aux endroits des taches.
|
||||||||||||||||||||||||||||||||||||
|
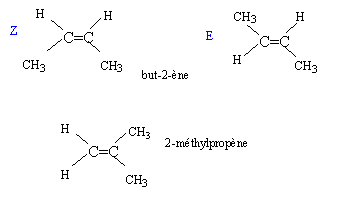
Un alcène CnH2n a pour masse molaire M= 56 g/mol.
corrigé M= 12n + 2n = 56 soit n= 4. C4H8 CH3-CH2-CH2=CH2 but-1-ène
|
|||||||||||||||||||||||||||||||||||||
|
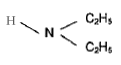
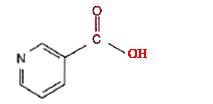
Le N',N-diéthylnicotinamide est employé comme stimulant central et respiratoire. 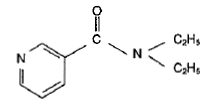
corrigé 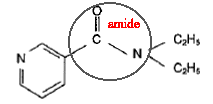
acide nicotinique :
|
|||||||||||||||||||||||||||||||||||||
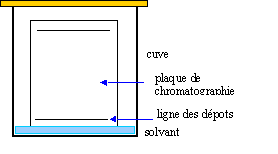
corrigé La chromatographie permet de séparer et d'identifier les constituants d'un mélange . Elle est basée sur la différence de solubilité d'un produit dans le solvant (l'éluant) et dans le support fixe solide On met l’éluant dans la cuve à chromatographie. Sur la plaque de chromatographie, on effectue les dépôts * Le niveau de l’éluant est inférieur au niveau des dépôts. * La cuve de chromatographie doit rester fermée. * Il faut sortir la plaque quand l’éluant arrive au trait supérieur. définition du Rf : distance parcourue par le corps pur X / distance parcourue par l'éluant Rf caractérise une substance pour un éluant donné.
|
|||||||||||||||||||||||||||||||||||||
|
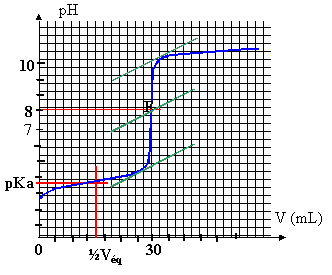
L'acide méthanoïque est un acide organique de formule HCOOH. La base conjuguée est l'ion méthanoate HCOO-. On dispose dans un bécher de 30 mL d'une solution aqueuse d'acide méthanoïque que l'on dose par une solution décimolaire de soude.
corrigé HCOOH + HO- = HCOO- + H2O
à l'équivalence les quantités de matière des réactifs sont en proportions stoéchiomètriques CaVa= CbVb avec Va = 30 mL ; Cb= 0,1 mol/L et Vb =Véqui = 31 mL Ca=CbVb /Va= 0,1*31/30 =0,103 mol/L. à la demi-équivalence le pH est égal au pKa : le pKa du couple HCOOH/HCOO- est proche de 3,8. Le pH de l'équivalence ( environ 8,2 dans ce cas) doit
appartenir à la zone de virage de l'indicateur coloré : la
phénolptaléine convient.
|
|||||||||||||||||||||||||||||||||||||
|
Les équations-bilans ci-dessous, toutes relatives à la formation d'ester ou d'amide, sont inccomplètes ; les compléter. A+ 2C6H5-NH2-->CH3-CH2-CO-NH-C6H5 + B + Cl-. CH3-CO-Cl + 2D --> E + CH3-NH3+ + Cl-. F + G = CH3-CH2-CH2-CO2-CH(CH3)2 + H I + 2NH3 --> J + CH3-CO2-+ K corrigé CH3-CH2-CO-Cl + 2C6H5-NH2-->CH3-CH2-CO-NH-C6H5 +C6H5-NH3+ + Cl-. CH3-CO-Cl + 2 CH3-NH2 --> CH3-CO-NH-CH3 + CH3-NH3+ + Cl-. CH3-CH2-CH2-CO2 H + HO-CH(CH3)2 = CH3-CH2-CH2-CO2-CH(CH3)2 + H2O [CH3-CO]2O + 2 NH3 --> CH3-CO-NH2 + CH3-CO2-+ NH4+.
|
|||||||||||||||||||||||||||||||||||||
|
|
 amine :
amine :