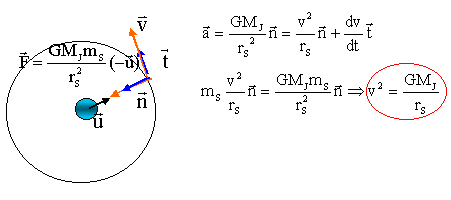|
d'après concours services de santé des armées 2005 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
Les trois parties sont indépendantes I. Dans les étoiles dont la masse est supérieure à 1,5 fois la masse du soleil le principal processus de fusion à l'origine de l'énergie libérée est le cycle CNO : 126C + 11H-->137N (1) ; 137N -->13ZX+ 01e (2) ; 13ZX+ 11H-->147N (3) 147N + 11H-->158O (4) ;158O -->A'Z'Y+ 01e (5) ; AZY+ 11H-->126C + 42He (6)
II. Energie de masse : On considère les deux réactions nucléaires suivantes : 73Li + 42He -->105B + 10n (a) ; 73Li + 42He -->115B (b)
m(He) = 4,0015 u ; m(Li 7) = 7,0144 u ; m(B 10) = 10,0102 u ; m(B 11) = 11,0066 u ; m(neutron)= mn = 1,0087 u ; m(proton) = mp=1,0073 u. 1 u = 1,66054 10-27 kg ; 1 eV= 1,602 10-19 J. III. Radioactivité artificielle : On bombarde des noyaux d'aluminium 27 par des particules a pour former l'isotope 30 du phosphore.
Demi vie du phoshore 30 : t½=156 s. 11Na ; 12Mg ; 13Al ; 14Si ; 15P ; 16S ; 17Cl ; 18Ar ; corrigé 13ZX + 11H-->147N + (3) conservation de la charge : Z+1= 7 soit Z= 6 , X est l'élément carbone. 158O -->A'Z'Y+ 01e (5) conservation du nombre de nucléons : 15 = A' conservation de la charge : Z'+1= 8 soit Z= 7 , X est l'élément azote 11H : proton, noyau d'hydrogène ; 01e : positon (1) fusion de petits noyaux ; (2) radioactivité de type b+.
(a) : Dm= m(B 10) + mn-m(Li 7)-m(Helium 4)= 10,0102+1,0087-7,0144-4,0015 = 3 10-3 u (b) : Dm= m(B 11) -m(Helium 4)--m(Li 7) =11,0066-4,0015-7,0144 = -6,3 10-3 u réaction (b) : à une diminution (perte) de masse correspond une libération d'énergie on appelle énergie de liaison notée El d'un noyau l'énergie que doit fournir le milieu extérieur pour séparer ce noyau au repos en ses nucléons libres au repos. 115O : 5 protons et 6 neutrons Dm = 5 mp+6mn-m(B 11) exprimée en u multiplier par 1,66054 10-27 pour esprimer Dm en kg. E= Dmc² , énergie en J et c= 3 108 m/s. diviser par 1,6 10-19 pour obtenir l'énergie en eV diviser par 106 pour obtenir l'énergie en MeV. L'énergie de liaison par nucléon d'un noyau est le quotient de son énergie de liaison par le nombre de ses nucléons: plus elle est élevée plus le noyau est stable. 42He :
28,45 / 4 = 7,1 MeV/nucléons ; 105B
: 65,12 / 11 = 6,51 MeV/nucléons.
3015P -->3014Si + 01e. loi de décrioissance radioactive : A(t) = A(0) exp(-lt) A(0) /A(t) = 7,2 1013 / 9 1012 = 8 = 23. l'activité diminue de moitié au bout d'une demi-vie ; est divisée par 4 au bout de 2 demi-vie et est divisée par 8 au bout de 3 demi-vie. t= 3*156 = 468 s.
|
||||||||||||||||||||||||||||||||||||||||||||
|
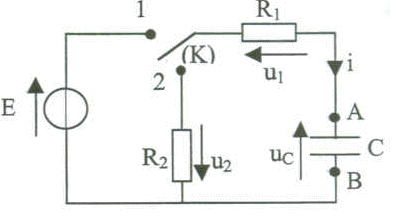
R1=R2=R . Le candidat respectera la notation et l'orientation du circuit.
corrigé E= u1+ uc avec u1 = R i ; i = dqA/dt ; qA= Cuc soit i = dqA/dt = Cduc/dt = Cu'c. E= Ri + uc ; E= RCu'c + uc ( équation différentielle) On pose t1 = RC. La charge est terminée au delà de t1 >= 5 t1. En fin de charge uc=E
; i=0 ; u1=0 ; u2=0.
uc+u1+u2 = 0 avec u1 = -Ri ; u2 = -Ri et i= -dqA/dt = -Cduc/dt. uc+ (-)R (-)Cduc/dt+ (-)R (-)Cduc/dt =0 uc + 2RC u'c=0( équation différentielle) On pose t2 = 2RC. au tout début de la décharge : uc=E ; i = - E/(2R) = -½E , u1 = - ½E ; u2 = -½E. uC= A exp(-t/t2) avec t2= 2RC dériver uc par rapport au temps : u'c= A/(-t2 ) exp(-t/t2) = - A/(2RC) exp(-t/t2) repport dans l'équation différentielle : A exp(-t/t2) + 2RC(- A/(2RC) exp(-t/t2)=0 A exp(-t/t2) - A exp(-t/t2) = 0 ; l'égalité est vérifiée. à t=0 : uc(0)= E = Aexp(0) =A. à t= t2 : uc= E exp(-1) = 0,37 E ; i = -Cu'c = -E/(2R) exp(-1)= -0,37 E/(2R)= 0,37 i(0) u1=u2 = -Ri = -R(0,37 E/(2R)) = -0,18 E. à t infini : uc=0 ; i=0 ; u1=u2=0.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
On étudie le mouvement du centre d'inertie d'une balle supposée ponctuelle, lancée d'un point A, situé à une hauteur h au dessus du sol. On admet que la balle est en chute libre dans le champ de pesanteur uniforme. On choisit l'instant où la balle est lancée comme origine des dates. 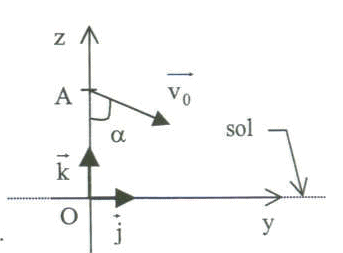
corrigé 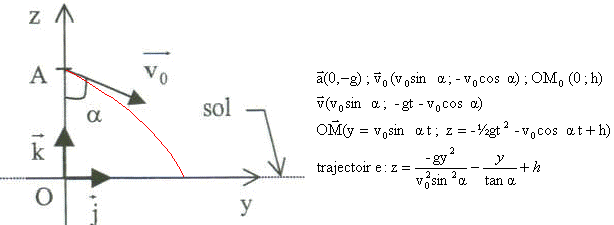
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Jupiter possède 16 satellites. On considère que Jupiter et ses satellites sont des corps à symétrie sphérique. I. Etude générale : On s'intéresse au mouvement du centre d'inertie d'un satellite de Jupiter en orbite circulaire autour de Jupiter. L'étude est faite dans un référentiel "jupiterocentrique" d'origine le centre de Jupiter et d'axes dirigés vers des étoiles fixes. Notations : Jupiter , masse MJ, centre d'inertie J ; satellite : masse mS, centre d'inertie S, rayon de la trajectoire rS et période TS. Constante de gravitation G.
II. Les satellites de Jupiter.On a représenté ci-dessous, pour les huit premiers satellites de Jupiter, les variations de la grandeur T² en fonction de la grandeur r3. G= 6,67 10-11 SI. 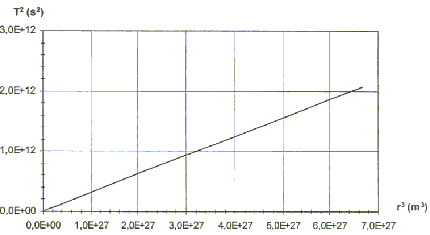
corrigé Le satelliote ( ou le point) est soumis à une force de gravitation centripète( dirigée vers le centre de Jupiter) La seconde loi de Newton, écrite sur l'axe de vecteur uitaire n donne :
Le satellite décrit une circonférence de rayon rS en une période notée TS à une vitesse v. 2prS=vTS. élever au carré : 4p²rS ²= v²T²S. remplacer v² par l'expression donnée ci-dessus : 4p²rS ²= GMJ / rS T²S. soit T²S / rS 3 = 4p² / (GMJ ) On retrouve la 3ème loi de kepler : T²S est proportionnelle à rS 3 . coefficient directeur de la droite : 2 1012 / 6,5 1027 = 3,07 10-16. 3,07 10-16= 4p² / (GMJ ) soit MJ= 4p² /( 3,07 10-11 G) MJ= 4*3,14²/(3,07 10-16 *6,67 10-11))= 1,92 1027 kg. |
|||||||||||||||||||||||||||||||||||||||||||||
|
corrigé C6H5COOH + HCH2OH = C6H5COOCH3 + H2O acide benzoïque et méthanol = benzoate de méthyle + eau Le réfrigérant n'est pas boucher : sinon il y aurait surpression ( du fait du dégagement de vapeurs lors du chauffage) et le bouchon sauterait. La réaction est lente, athermique et limitée par l'hydrolyde de l'ester. Le chauffage permet d'accéléré la réaction et d'atteindre plus rapidement l'équilibre. L'acide sulfurique sert de catalyseur. Avec l'anhydride benzoïque, utilisée à la place de l'acide, la réaction est totale. C6H5-CO-O-OC-C6H5.
Dans l'ampoule à décanter, les solvants ether et eau non miscibles, se répartissent de telle manière que le solvant le plus dense, l'eau, occupe la partie inférieure, l'ether, moins dense, occupant la partie supérieure. C6H5COOH + HO- -->C6H5COOH + H2O H2SO4 + 2HO- --> SO42- + 2H2O En milieu basique, l'acide carboxylique est sous forme d"ion carboxylate, soluble dans l'eau ; l'alcool restant est également soluble dans l'eau. Les autres ions, sulfate, ion sodium, se trouvent dans l'eau. L'ester se trouve seul dans la phase éthérée. Par contre, sans l'hydroxyde de sodium, l'acide carboxylique restant serait en grande partie dans la phase éthérée. Réaction parasite : saponification de l'ester, lente mais totale. Il faut extraire assez rapidement et surtout pas 12 heures plus tard. |
|||||||||||||||||||||||||||||||||||||||||||||
|
Cette électrolyse conduit à la production de dichlore Cl2 et de soude (Na+ + HO-). On réalise le montage ci-dessous. 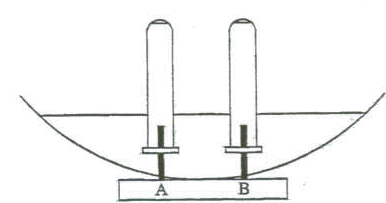 Les deux tubes à essais sont remplis d'eau salée dans laquelle on a introduit un peu de phénolphtaléine et retournés au dessus des électrodes de graphite. La cuve est un électrolyseur rempli d'eau salée. On relie l'électrode A à la borne positive et l'électrode B à la borne négative d'un générateur de tension continue. On observe rapidement un dégagement gazeux au niveau de chaqune électrode aainsi qu'une coloration rose à l'une des électrodes. Après 10 min d'électrolyse, on mesure le volume de gaz recueilli sur chaque électrode. Sur A, VA= 24 mL ; sur B, VB= 24 mL En approchant une allumette emflammée au niveau de l'un des tubes,que l'on vient juste de retourner, on entend un "pop" caractéristique. masse atomique molaire (g/mol) H : 1 ; O : 16 ; Cl : 35,5 ; Na : 23. volume molaire des gaz : Vm= 24 L/mol. 1 F= 105 C/mol couple redox : Cl2/Cl- ; H2O/H2 [ 2 H2O + 2e- = H2(g) + 2HO-]
corrigé 2Cl- = Cl2 + 2e- oxydation de l'ion chlorure ( l'ion chlorure est le réducteur) à l'anode positive A. La coloration rose met en évidence d'un milieu basique dans lequel l'ion HO- est majoritaire. Le "pop" met en évidence le gaz dihydrogène. 2 H2O + 2e- = H2(g) + 2HO- réduction de l'eau ( l'eau est l'oxydant) à la cathode négative B. Bilan de l'électrolyse : 2Cl- +2
H2O =Cl2 (g) +H2(g)
+ 2HO-
quantité de matière d'électrons débitée par le générateur : 2Cl- = Cl2 + 2e- donne : n( électrons ) =2 n( Cl2) = 2 10-3 mol. Quantité d'électricité : Q = 105*2 10-3 = 200 C Or Q= I t soit I= 200 / (60* 10) =1/3 = 0,33 A.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|