|
acoustique
; thermodynamique ; GPL
d'après
bts EEC 2004
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
acoustique
( 6,5 points)
Données : seuil d'audibilité I0 =
10-12 W m-2 ; célérité du
son dans l'air : 344 m/s.
Une source sonore S émet un son de fréquence f= 1000 Hz
avec une puissance P= 2,32 W. Cette source, supposée ponctuelle, émet
des ondes sphériques.
- Donner la définition de la longueur d'onde puis
calculer sa valeur.
- Quelque soit M, un point situé à la distance d=SM de
la source S, l'intensité sonore en ce point M a pour expression I= P/ (4pd²). Soit un point M, situé à
une distance d1= 2,15 m. Calculer l'intensité
sonore I1 au point M1 et
le niveau sonore L1 correspondant (dB)
- On s'éloigne de la source jusqu'au point M2
situé à une distance d2 à calculer. Le niveau
sonore mesuré vaut L2=94 dB. Déterminer
l'expression littérale de l'intensité sonore I2
puis calculer I2.
- En déduire la distance d2.
- Le point M2 se trouve à
proximité d'un mur qui donne sur un hangar industriel. Avec le
sonomètre, on mesure le niveau sonore L3, en un
point M3, situé tout juste de l'autre côté de ce
mur, à l'intérieur du hangar. On suppose que le niveau sonore à
l'intérieur du hangar est suffisamment faible pour ne pas influer sur
la mesure de L3. Le mur possède un coefficient
de transmission acoustique t
= 6,3 10-4.
- Donner l'expression de l'affaiblissement phonique R de ce mur en
fonction des niveau sonore L2 et L3.
- L'affaiblissement en fonction du coefficient de transmission est
donné par R= 10 log 1/t.
Calculer R et vérifier que la valeur indiquée par le sonomètre vaut 62
dB.
- En fait, au point M3, à
l'intérieur du hangar, un son de niveau sonore L4
= 68 dB se supperpose au son de niveau L3.
calculer le niveau sonore réel L reel indiqué
par le sonomètre. Conclure.
corrigé
longuer
d'onde l (m) = distance parcourue par l'onde en une
période.
l (m) = c/f = 344 / 1000 = 0,344 m.
intensité sonore I1 = P/ (4pd1²)=
2,32 / (4*3,14*2,15²) = 0,04 W/m²
niveau sonore L1 = 10 log (I1/I0)
= 10 log (0,04 / 10-12) = 106 dB.
niveau sonore L2 = 10 log (I2/I0)
; log (I2/I0) = 0,1 L2
; I2/I0 = 10 0,1
L2 ;
I2 = I010 0,1
L2 = 10-12 * 109,4
= 10-2,6 = 0,0025 W/m²
distance d2 : 4pd2²= P/I2
; d2²= P/(4pI2
)= 2,32 / (4*3,14*0,0025)= 73,5 m.
prendre la racine carrée : d2 = 8,6 m.
l'affaiblissement phonique R de ce mur en fonction des
niveau sonore L2 et L3 :
R =| L3- L2|
R= 10 log 1/t
= 10 log 1/ 6,3 10-4
=32 dB
d'où L3 = L2-32
= 94-32 = 62 dB.
seules les
intensités acoustiques s'ajoutent :
I3 = I0 10
0,1 L3 = 10-12 * 106,2
= 10-5,8 = 1,58 10-6 W/m².
I4 = I0 10
0,1 L4 = 10-12 * 106,8
= 10-5,2 = 6,3 10-6 W/m².
I3 + I4 =
7,88 10-6 W/m².
Lréel = 10 log (I3
+ I4) / I0 = 10 log (7,88
10-6 / 10-12)= 69 dB.
Le bruit extérieur est insignifiant par rapport au bruit
issu de l'intérieur du hangar ; l'augmentation du niveau sonore, du au
bruit extérieur, n'est que de 1 dB.
|
|
Thermodynamique
(7,5 points)
Les parties A et B sont indépendantes.
A.
On se propose de comprimé un volume VA=9 L
d'air, gaz supposé parfait, initialement à la pression PA=
105 Pa en faisant passer son volume de 9 L à 1
L. La compression peut être éffectuée de deux façons différentes :
- compression 1 : à deux étages de pression
A-->C-->D-->E-->B
- compression adiabatique réversible de A--> B
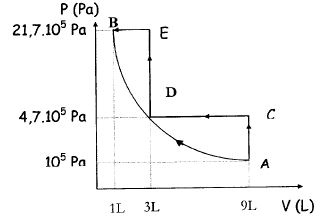
- Indiquer le nom de chaque transformation AB, CD, DE,
EB.
- A partir du diagramme P=f(V) calculer les différentes
températures en C, D, E, B sachant que la température en A est TA=
300 K.
- Quand dit-on qu'une transformation est adiabatique ?
- Quelle est la relation caractéristique d'une transformation
adiabatique réversible parmi les relations suivantes : PV= constante ;
PVg=
constante ; PTg
= constante ; Justifier en utilisant le diagramme P=f(V). On donne g = 1,4
B.
Un véhicule fonctionne au GPL ( gaz de pétrole liquéfié) Le volume
intérieur du réservoir est V= 100 L.
- Lors du remplissage du réservoir à la température q= 15°C le GPL occupe 85 % du
réservoir sous forme liquide et le reste sous forme gazeuse. La
pression P1 du gaz est alors 4,5 105
Pa. Dans ces conditions le GPL liquide a une masse volumique r= 560 kg m-3.
Calculer la masse de GPL liquide contenue dans le réservoir.
- Rappeler l'équation d'état des gaz parfaits.
- La phase gazeuse du GPL est assimilée à un gaz parfait de masse
molaire 50 g/mol. Calculer la masse de GPL présent dans le réservoir
sous forme gazeuse. R= 8,31 J mol-1 K-1.
- Le GPL est puisé dans le réservoir à l'état liquide.
Il passe ensuite à l'état gazeux, il est vaporisé. La chaleur
nécessaire à cette transformation est fournie par le circuit de
refroidissement du moteur. On suppose qu'à un instant donné, le débit
du GPL liquide est de 0,16 L par minute. La chaleur latente de
vaporisation du GPL est dans ces conditions Lv=
365 kJ /kg. Calculer la puissance thermique qui doit être fournie par
le circuit de refroidissement du moteur pour obtenir la vaporisation du
GPL.
corrigé
transformation
AB : compression adiabatique ; CD : isobare ; DE: compression isochore
; EB : isobare.
VC= VA = 9
10-3 m3 ; PC=PD=
4,7 105 pa ; PA= 105
pa ; TA= 300 K
Qté de matière du gaz : PV= nRT soit n = PA VA/(RTA)
= 105 * 9 10-3/(8,31*300)
= 0,361 mol
TC= VCPC
/ (nR) = 9 10-3 4,7 105 /
(0,361*8,31)= 1410 K.
TD= VDPD
/ (nR) = 3 10-3 4,7 105 /
(0,361*8,31)= 470 K.
TE= VEPE
/ (nR) = 3 10-3 21,7 105
/ (0,361*8,31)= 2170 K.
TB= VBPB
/ (nR) = 10-3 21,7 105 /
(0,361*8,31)= 723,3 K.
Dans une
transformation adiabatique il n'y a pas d'échange d'énergie entre le
système étudié et l'extérieur.
PVg=
constante
d'après le graphe, si la pression augmente, alors le
volume diminue.
Entre A et B, le volume est divisé par 9 et la pression
est multipliée par 21,7 ; or 91,4 = 21,67.
85 L=
0,085 m3 ; r=
560 kg m-3 ; masse du GPL liquide : 0,085*560 = 47,6 kg.
l'équation d'état des gaz parfaits PV= nRT
P= 4,5 105 Pa ; V= 15 L = 0,015 m3
; T= 273+15 = 288 K
n = PV/(RT)= 4,5 105*0,015/(8,31*288)
= 2,82 mol
masse (g) = Qunatité de matière (mol) * masse molaire
(g/mol) = 2,82*50 = 141 g.
débit
volumique : 0,16 10-3 / 60 = 2,67 10-6
m3/s.
débit massique = débit volumique * masse volumique =
2,67 10-6 *560 =1,49 10-3
kg/s
Puissance thermique (kW) = débit massique * chaleur
latente = 1,49 10-3 * 365 = 0,545 kW.
|
|
GPL
(6 points)
Le gaz de pétrole
liquéfié ( GPL) utilisé en France pour les voitures est un mélange de
deux hydrocarbures qui ont pour formule C3H8
et C4H10.
- Quels sont les
noms de ces hydrocarbures ? A quelle famille d'hydrocarbures
appartiennent-ils ? Quelle est la caractéristique de cette famille
d'hydrocarbures ?
- La combustion
complète des hydrocarbures dans le dioxygène donne du dioxyde de
carbone et de l'eau. Ecrire et équilibrer l'équation bilan de la
combustion complète pour chacun des hydrocarbures qui constituent le
GPL.
- Une voiture a une
consommation moyenne de 10,5 L de GPL aux 100 km. La masse volumique du
GPL liquide est 0,56 kg/L. On considère que le GPL , est constitué, en
masse de 50 % de C3H8 C4H10
et de 50 % de C4H10.
Calculer pour 1 km pzrcouru et pour chacun des deux hydrocarbures.
- La masse utilisée.
- Le nombre de moles correspondant.
- Le nombre de moles de dioxyde de carbone produit.
- La même voiture
fonctionnant à l'essence a une consommation de 8,5 L aux 100 km et pour
1 km parcouru, dégage dans l'atmosphère un volume de dioxyde de carbone
de 108 L. Comparer la pollution au dioxyde de carbone produite par le
GPL et par l'essence. Le volume molaire des gaz est 24 L/mol dans ces
conditions.
masse atomique molaire ( g/mol) : C: 12 ; H : 1 ; O : 16.
corrigé
propane ,
butane , alcanes, hydrocarbures saturés.
C3H8
+ 5 O2 --> 3 CO2 +
4H2O
C4H10
+6,5 O2 --> 4 CO2
+ 5H2O
pour 100
km, masse de GPL consommée : 10,5*0,56 = 5,88 kg
pour 1 km : 58,8 g
soit 29,4 g propane et 29,4 g butane
masse molaire propane
: 3*12+8 = 44 g/mol ; butane : 4*12+10 = 58 g/mol
Qté de matière (mol)
= masse (g) / masse molaire (g/mol)
propane : 29,4 / 44 =
0,668 mol donnant 0,668*3 = 2 mol CO2.
butane : 29,4 / 58 =
0,507 mol donnant 4*0,507 = 2,03 mol CO2.
total CO2
: 4,03 mol.
Qté
matière dioxyde de carbone (mol) = volume (L) / volume molaire (L/mol)
= 108 / 24 = 4,5 mol
l'essence conduit à
une pollution plus importante que le GPL.
|
|
retour
-menu
|

