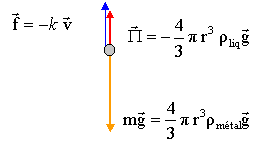|
étude
cinétique d'une réaction ;
étude
thermodynamique de la complexation des ions Cu(II) ;
maintenance
de l'électronique d'un spectrophotomètre
sédimentation
d'après
bts analyses biologiques 2004
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
étude
cinétique d'une réaction (
7,5 points)
On considère la réaction entre un ester et l'ion
hydroxyde, qui conduit à la formtion d'un alcool et d'un ion
carboxylate.
- Etude de la réaction : l'équation générale de la
réaction est : ester + HO- = alcool + ion
carboxylate
- De quelle réaction s'agit-il ?
- Est-elle totale/ limitée ?
- Est-elle lente / rapide ?
- Ecrire l'équation entre l'éthanoate d'éthyle et l'hydroxyde de
sodium. Nommer les produits.
- Donner le mécanisme de la réaction.
- Citer une application industrielle de la saponification.
- Cinétique de la réaction :
- Exprimer la vitesse de disparition de l'ester en fonction des
concentrations des réactifs. On note k, la constante de vitesse, a :
l'ordre partiel par rapport à l'ester; b : l'ordre partiel par rapport
à l'ion hydroxyde.
- Afin de déterminer l'ordre a, on fixe le pH de la solution en
utilisant des ions polyphosphates. Le pH reste constant pendant l'étude
cinétique. Que peut-on dire de la concentration des ions HO-
au cours du temps ? Réécrire l'expression de la vitesse de disparition
de l'ester en notant k' la constante apparente.
- On obtient les résultats suivants :
|
T en h
|
0
|
2
|
5
|
10
|
20
|
30
|
40
|
|
[ester] mmol/L
|
10
|
8,7
|
7,1
|
5
|
2,5
|
1,25
|
0,6
|
Vérifier que ln(ester) est une fonction affine du temps. Que peut-on en
déduire sur la valeur de a
Déterminer graphiquement k'.
Définir le temps de demi-réaction et déterminer sa valeur.
Comment varie le temps de demi-réaction si on refait l'expérience à
60°C ?
corrigé
saponification, lente, totale
CH3COO-C2H5
+ NaOH = CH3COONa + C2H5OH
les produits sont
l'alcool éthylique et l'éthanoate de sodium
mécanisme :
attaque du nucléophile HO- sur le carbone du
groupe ester ( étape lente déterminante).
puis rapidement il se
forme un acide caboxylique et un ion alcoolate
enfin on passe
rapidement à l'ion carboxylate et à l'alcool
application
industrielle : fabrication des savons.
vitesse v
= -d[ester]/dt = -k[ester]a[HO-]b.
si le pH reste
constant alors [HO-]= 10-14
/ [H3O+]= 10-14
/ 10-pH = constante.
vitesse v =
-d[ester]/dt = -k'[ester]a.
|
T en h
|
0
|
2
|
5
|
10
|
20
|
30
|
40
|
|
[ester] mol/L
|
10 10-3
|
8,7 10-3
|
7,1 10-3
|
5 10-3
|
2,5 10-3
|
1,25 10-3
|
0,6 10-3
|
|
ln[ester]
|
- 4,6
|
- 4,74
|
- 4,95
|
- 5,3
|
-6
|
- 6,68
|
- 7,42
|
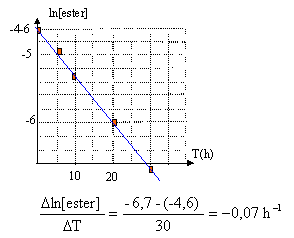
Le temps de demi-réaction est la durée au bout de
laquelle le taux d'avancement final est égale à 0,5. Dans ce cas, c'est
la durée au bout de laquelle la moitié du réactif limitant, l'ester, a
disparu. D'après le tableau on trouve 10 heures.
La vitesse de la réaction croît avec la température ; en
conséquence le temps de demi-réaction diminue si la température
augmente.
|
|
étude
thermodynamique de la complexation des ions Cu(II) (4 points)
Le but de cet exercice est de déterminer par une étude
thermodynamique la constante globale b4
de l'équilibre de formation de l'ion complexe tétrammine cuivre II
suivant la réaction : Cu2+ + 4 NH3
= Cu(NH3)42+.
- Calculer l'enthalpie standart de la réaction de
formation de l'ioncomplexe DrH°.
- Calculer l'entropie standart de la réaction DrS°.
- Calculer à 25°C, l'enthalpie libre standart de la
réaction DrG°.
- Commenter le signe de DrH°,
DrS°,
DrG°.
- En déduire la constante b4
. Commenter sa valeur.
|
Cu2+
|
NH3
|
Cu(NH3)42+
|
|
DrH°
kJ mol-1
|
65,8
|
-80,3
|
-349
|
|
DrS°
J K-1mol-1
|
-97,2
|
111
|
274
|
R= 8,314 J K-1 mol-1.
corrigé
DrH°= DrH°(complexe)
- 4 DrH°(NH3)
- DrH°(Cu2+)
DrH°=
-349 - 4*(-80,3) -65,8 = -93,3 kJ mol-1
DrS°=
DrS°(complexe)
- 4 DrS°(NH3)
- DrS°(Cu2+)
DrS°=
274-4*111-(-97,2) = -72,8 J K-1mol-1
DrG°
= DrH°
- TDrS°=
-93,3 103- 298 *(-72,8) = -71,6 kJ mol-1.
DrG°
négatif : la réaction évolue spontanément vers la
formation du complexe.
DrH°
négatif : réaction exothermique, chaleur cédée au
milieu extérieur.
DrG°
= - RT ln b4
; ln b4
= -DrG°
/( RT)= 71600 / (8,314*298) = 28,9
b4
=3,56 1012.
Cette valeur est importante : le complexe est
particulièrement stable.
|
|
maintenance
de l'électronique d'un spectrophotomètre (4,5 points)
L'électronique
d'amplification d'un spectrophotomètre est réglée, par construction,
pour fonctionner à une température moyenne de 20°C. En ce mois de juin,
une alarme s'est déclenchée sur le spectrophotomètre car la température
du laboratoire dépasse la valeur seuil. C'est l'étude de l'électronique
d'amplification qui est proposée. L'amplificateur opérationnel est
considéré comme parfait. i+= i-
= 0 et ud=0 V.
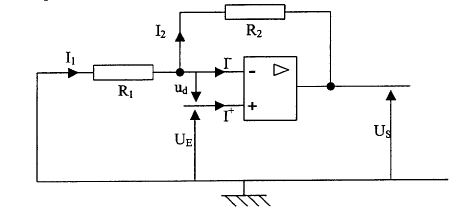
- Exprimer I1
en fonction de UE et R1.
- Exprimer I2
en fonction de UE , US et
R2.
- En déduire US=
(1+R2/R1)UE.
- Pour pouvoir
réutiliser le spectrophotomètre, il suffit de règler le potentiomètre R2.
A la température moyenne de 20 °C, le rapport US/UE
vaut 10 ; sachant que R1 = 2200 W calculer la valeur de R2.
- A la température
du laboratoire au mois de juin, il faut, selon le constructeur du
spectrophotomètre, régler le rapport US/UE
à la valeur 9. Calculer la valeur à laquelle il faut régler R2.
corrigé
UE
= - R1I1 ; I1
= -UE / R1
US+R2I2=
UE ; I2= (UE
- US) / R2
or I1=I2
car i+ = 0
-UE
/ R1=(UE - US)
/ R2 ; -UE R2
= (UE - US)
R1
US
R1 = UE(R1+R2
)
US
= (1+R2/R1)UE.
à 20°C : US/UE
= 10 = 1+R2/R1 ; 9 = R2/R1
; R2 = 9 R1 = 19,8 kW.
à une température
plus élevée : US/UE = 9 =
1+R2/R1 ; 8 = R2/R1
; R2 = 8 R1 = 17,6 kW.
|
|
sédimentation
(4 points)
On se propose
d'étudier la sédimentation de la nucléohistone en solution aqueuse,
sous l'effet de la pesanteur.
- Coefficient de
frottement d'une particule supposée sphérique :
- La molécule de nucléohistone a une masse m= 3,5 10-21
kg. En supposant la molécule sphérique, déterminer son rayon. Masse
volumique de cette molécule m=
1520 kg m-3.
- En supposant toujours la molécule sphérique et à l'aide de la loi de
Stockes déterminer la valeur du coefficient de proportionnalité k = 6phR de la force de frottement à la vitesse.
(viscosité h = 1,005 10-3 Pa s)
- Ce coefficient vaut en réalité 4,35 10-10u SI
; la molécule est-elle sphérique ? Sinon proposer une forme pour la
molécule.
- Sédimentation de
la particule réelle :
- Faire le schéma de toutes les forces qui s'exercent sur cete molécule.
- Le mouvement de la molécule devient rapidement rectiligne uniforme. A
l'aide du bilan précédent, établir que la vitesse de sédimentation peut
s'exprimer par la relation v = mg/k(1-m'/m
)où m et m '
désignent respectivement la masse volumique de la nucléohistone et de
l'eau. Calculer cette vitesse pour la molécule réelle.
- Quelle serait la durée nécessaire pour qu'elle sédimente sur 1 cm ?
- Quelle technique pourrait-on utiliser afin de réduire notablement
cette durée ?
corrigé
volume (m3)
= masse (kg) / masse volumique (kg m-3) = 3,5 10-21
/ 1520 = 2,3 10-24 m3.
volume d'une sphère
V= 4/3pR3 soit R3
= 3V(4p)
R3
= 2,3 10-24 * 3 / (4*3,14)= 5,5 10-25
; R= 8,19 10-9 m.
k = 6phR = 6*3,14*1,005 10-3
* 8,19 10-9 = 1,55 10-10
valeur différente,
trois fois plus faible, que la valeur réelle : la molécule n'est pas
sphérique mais a une forme assez éloignée de la sphère ( éllipse assez
allongée ou cylindre).
La
molécule est soumise à son poids, à la poussée d'Archimède et à une
force de frottement fluide.
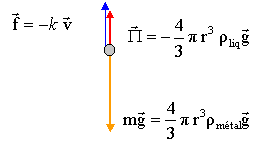
lors d'un mouvement
rectiligne uniforme : Vmg
= k vlimite + Vm'g
vlimite
= Vg/k ( m - m')
avec m = Vm ou V = m/ m
vlimite
= mg/k( 1-m'/m)
vlimite
= 3,5 10-21 *9,81/ 4,35 10-10(1-1000/1520)=
2,7 10-11 m/s.
Durée nécessaire pour
qu'elle sédimente sur 0,01 m : 0,01 / 2,7 10-11
= 3,7 108 s.
technique pour
réduire notablement cette durée : ultracentrifugation
|
|
retour
-menu
|