|
d'après F. Brossard En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
On effectue le suivi cinétique par spectrophotométrie d'une transformation lente mettant en jeu une réaction entre l'acide oxalique H2C2O4 et les ions permanganate MnO4-. Dans le système étudié, seul l'ion permanganate est coloré en solution. I. Réglage du spectrophotomètre Les mesures sont réalisées à une longueur d'onde où l'absorbance A est la plus grande possible afin d'avoir une meilleure précision. Pour choisir cette longueur d'onde, on réalise le spectre d'absorption de solutions diluées de permanganate de potassium (K+(aq) + MnO4-(aq) ) qui est reproduit ci-dessous pour différentes concentrations. 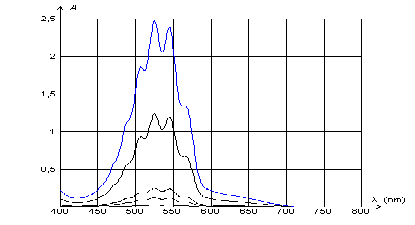 On rappelle que lorsqu'une solution absorbe un rayonnement électromagnétique visible correspondant à une "couleur", la solution apparaît alors de la couleur dite "complémentaire" à la "couleur absorbée". Une "étoile des couleurs" (sur laquelle le rayonnement absorbé et la couleur complémentaire sont diamétralement opposée) est fournie. 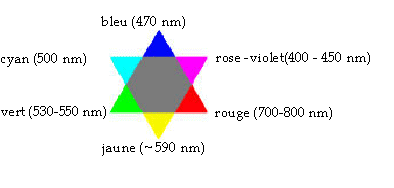
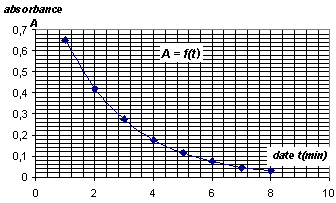
II. Suivi de la transformation Dans un becher de 100 mL, on introduit un volume V1 = 10,0 mL d'une solution de permanganate de potassium acidifiée de concentration C1 = 1,0 × 10-3 mol. L-1 en ions permanganate. A l'instant t = 0, on ajoute un volume V2 = 10,0 mL d'une solution d'acide oxalique (incolore) de concentration C2 = 1,0 ×10-2 mol. L-1. On homogénéise le mélange et on en verse rapidement une partie dans une cuve de spectrophotomètre. On mesure toutes les minutes l'absorbance A de la solution et on note les résultats obtenus dans le tableau ci-dessous :
III. Etude de la vitesse
Rose, voire violette à forte concentration La solution absorbe dans le domaine du vert (autour des 550 nm) or d'après l'étoile des couleurs "sa" couleur complémentaire est le rose. 2 fois { MnO4- + 5e- + 8 H+ = Mn2+ + 4 H2O} réduction de l'oxydant 5fois { H2C2O4 = 2CO2 + 2 e- + 2H+ } oxydation du réducteur. On observe une disparition de la coloration violette n(MnO4-)0
= V1C1= 10-5 mol et n(H2C2O4)0
=V2C2= 10- 4 mol
si l'acide oxalique est limitant 10-4-5xmax =0 soit xmax = 2 10-5 mol (la plus petite
valeur "l'emporte"). xmax = 5,0.10-6 mol, et c'est MnO4- le réactif limitant.
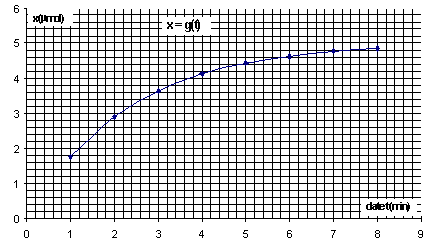
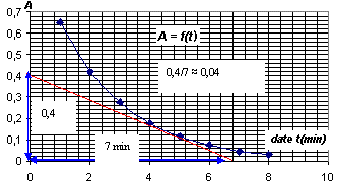
[MnO4-]0 =10-5 / 20 10-3 = 5 10-4 mol/L = ½C1. à une date t : [MnO4-]= ½C1- 2x/ V. Or A(t) = k . [MnO4-] d'où A(t) = k( ½C1- 2x/ V) A(t) / k = ½C1- 2x/ V ; ½C1-A(t) / k= 2x/ V ; x = ½V(½C1-A(t)/k )= VC1- A(t) V/(2k). dériver par rapport au temps : dx/dt = - V/2k dA/dt v= 1/V dx/dt = -1/(2k) dA/dt La vitesse de réaction décroît au cours de temps car la concentration molaire des réactifs ( facteur cinétique) diminue.
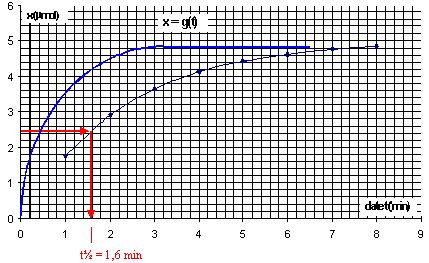
v= - 1/(2k) [dA/dt] t=5 min= 1/4103*0,04 = 10-5 mol L-1 min-1. Le temps de demi réaction, t½, est le temps au bout duquel l'avancement vaut la moitié de l'avancement final (ici xmax). x(t1/2) =½ xmax = 2,510-6 mol Graphiquement on trouve t½ = 1,6 min. La température est un facteur cinétique dont l'augmentation entraîne une hausse de la vitesse.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|