|
d'après bac Antilles sept 2005. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||
|
|||
|
|
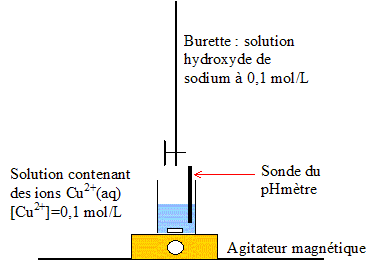
Le minerai de cuivre contient des impuretés en particulier du fer. À partir de ce minerai, on prépare une solution aqueuse contenant des ions cuivre II (Cu2+(aq)) et des ions fer III (Fe3+(aq)). Le but de l'exercice est de comparer deux méthodes possibles pour réaliser la séparation des ions Cu2+(aq) des ions Fe3+(aq) présents dans une même solution. Cette séparation ne nécessite pas que les éléments fer et cuivre soient en solution aqueuse à la fin des transformations envisagées. Données : La constante de réaction Ke associée à la réaction d'autoprotolyse de l'eau 2H2O(l) = H3O+(aq) + HO-(aq) est Ke = 10-14 (à 25°C) Masses molaires atomiques: M(Fe) = 55,8 g.mol-1 ; M(Cu) = 63,5 g.mol-1. A . Technique par précipitation
B . Oxydo-réduction : Les ions cuivre (II) Cu2+ (aq) réagissent avec le métal fer pour donner naissance au cuivre métal et aux ions fer (II) Fe2+ (aq) . La transformation peut être décrite par la réaction d'équation : Cu2+ (aq) + Fe (s) = Cu (s) + Fe2+ (aq). (réaction 3) Les ions fer (III) réagissent avec le métal fer pour donner des ions fer (II) Fe2+ (aq). La transformation peut être décrite par la réaction d'équation : 2 Fe3+ (aq) + Fe (s) = 3 Fe2+ (aq) (réaction 4) On dispose d'une solution S1 de volume V1 = 200 mL contenant des ions Cu2+ (aq) et Fe3+ (aq). Dans un becher contenant la totalité de cette solution, on ajoute 10 g de fer en poudre, on estimera que cette masse est suffisante pour que la totalité des ions cuivre (II) et fer (III) réagisse.
Conclusion : On dispose d'une solution contenant des ions Cu2+ (aq) et des ions Fe3+ (aq) , ces derniers étant présents en très faible quantité. Cette solution doit être utilisée pour préparer du cuivre métallique par électrolyse des ions Cu2+ (aq), il est donc nécessaire d'éliminer les ions Fe3+ (aq). Quelle méthode (précipitation ou oxydo-réduction) doit-on utiliser ?
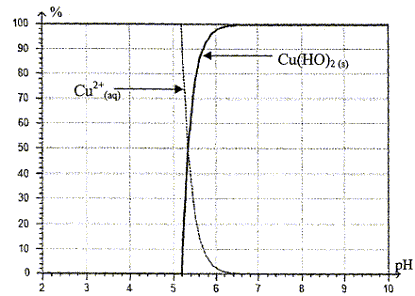
Cu2+ (aq) + 2 HO- (aq) = Cu(HO)2 (s) expression de la constante d'équilibre K1 : K1= 1/( [Cu2+]éq[HO-]éq2) le quotient de réaction noté Qr s'exprime par : Qr= 1/( [Cu2+][HO-]2) si Qr < K1 la réaction évolue dans le sens direct, formation de Cu(OH)2(s). A l'apparition du précipité Qr = K1 et la concentration en ions Cu2+ (aq) à l'équilibre, notée [Cu2+(aq)]éq, vaut toujours 0,10 mol.L-1 . [HO-]2éq = 1/( [Cu2+]éqK1) = 1/(0,1*4,0.1018) = 2,5 10-18 prendre la racine carrée :[ HO-]éq = 1,6.10-9 mol.L-1 . Or [H3O+(aq)][ HO-(aq)]= Ke = 10-14 d'où [H3O+(aq)] = Ke / [ HO-(aq)] = 10-14 / 1,6 10-9 = 6,2 10-6 mol/L pH= -log (6,2 10-6)=5,2 On retrouve bien le résultat énoncé ci-dessus : le précipité
apparaît à partir de pH=5,2.
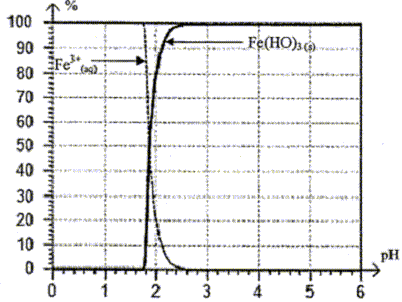
A pH=4 tous les ions Fe3+(aq) ont précipité sous forme de Fe(OH)3(s) de couleur rouille recueilli sur le filtre. l'espèce chimique présente dans la solution S1 est Cu2+(aq) qui ne précipite qu'à partir de pH=5,2. Comment vérifier que la solution S1 ne contient plus qu'une seule des espèces chimiques Cu2+ (aq) ou Fe3+ (aq) présentes initialement : la solution est de couleur bleue ; en ajoutant une goutte de
soude on n'observe pas la formation d'un solide de couleur rouille ; en
ajoutant quelques gouttes de soude le pH va atteindre la valeur 5,2 et
le solide bleu Cu(OH)2 va apparaître.
On dispose d'une solution contenant des ions Cu2+ (aq) et des ions Fe3+ (aq) , ces derniers étant présents en très faible quantité. Cette solution doit être utilisée pour préparer du cuivre métallique par électrolyse des ions Cu2+ (aq), il est donc nécessaire d'éliminer les ions Fe3+ (aq) Les ions Fe3+ (aq) doivent se trouver sous forme solide et les ions Cu2+(aq) doivent rester en solution ce qui exclu la séparation par oxydo réduction : il reste la méthode par précipitation en se plaçant à pH<5,2.
|
||
|
|