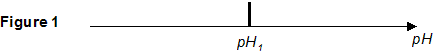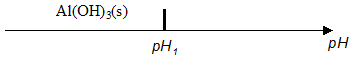|
d'après bac France sept 2005. Calculatrice interdite En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Les parties 1 et 2 sont indépendantes.
En 2004 la production mondiale d'aluminium s'est élevée à 26 millions de tonnes. L'objectif de cet exercice est l'étude simplifiée du protocole industriel permettant la production de l'aluminium. 1. Première partie: extraction de l'alumine, matériau de base de l'aluminium La bauxite, minerai qui contient principalement de l'alumine (de formule brute Al2O3(s) ) est d'abord pulvérisée puis mélangée dans des autoclaves à une solution de soude qui permet de dissoudre l'alumine, tandis que les impuretés demeurées à l'état solide sont éliminées par lavage et filtration. La solution restante est refroidie et on diminue son pH. On constate alors l'apparition d'un précipité d'alumine tri-hydratée de formule écrite de manière simplifiée Al(OH)3(s). Ce précipité est porté à environ 1000°C dans des fours. Il reste alors de l'alumine Al2O3(s) pure, sous forme de poudre blanche. D'après http://www.aac.aluminium.qc.ca Données: - Après la dissolution de l'alumine, la solution étant "très" basique, l'élément aluminium se retrouve sous la forme d'ions aluminate Al(OH)4 -(aq) - À des pH moins basiques il apparaît un précipité. L'état d'équilibre correspondant peut être modélisé par l'équation suivante : Al(OH)4 -(aq) = Al(OH)3(s) + HO - (aq) équation (1) La constante d'équilibre à 25 °C de cette équation est: K = 1,0 10- 1 - La solubilité de l'alumine tri-hydratée Al(OH)3(s) diminue lorsque la température diminue. - Le produit ionique de l'eau Ke à 25 °C vaut 1,0 10-14.
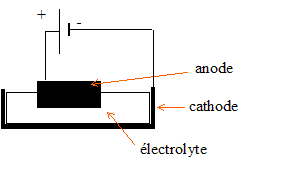
Deuxième partie: la transformation de l'alumine en aluminium L'aluminium est tiré de l'alumine par réduction électrolytique qui s'effectue dans des cuves que traverse un courant continu à haute intensité ( de l'ordre de 105 A sous une tension d'environ 4 V). Les cuves sont revêtues de blocs de carbone qui forment la cathode. Ces cuves contiennent un électrolyte en fusion qui dissout l'alumine Al2O3(s) qui y est apportée. Les anodes, constituées de carbone très pur, plongent dans l'électrolyte. Par électrolyse, à une température d'environ 950 °C, l'alumine est transformée en aluminium et en oxygène. L'aluminium liquide se dépose au fond de la cuve, où il est récupéré puis solidifié après refroidissement. Données: - La réaction de dissolution de l'alumine peut-être modélisée par l'équation chimique suivante: Al2O3(s) = 2 Al 3+ + 3 O 2- - On admet que, dans cette phase, l'électrolyte, non aqueux, est constitué des ions suivants Al3+ et O2-. - Couples mis en jeu lors de l'électrolyse: Al 3+ / Al (s) ; O2 (g) / O 2- - La réaction d'électrolyse de l'alumine s'écrit: 4 Al 3+ + 6 O2- = 3 O2 (g) + 4 Al(s) - Définition de l'intensité I: I = Q/Dt où Q est la quantité d'électricité qui transite dans l'électrolyte durant la durée D t. Masses molaires atomiques (g.mol-1) : Al =27,0 ; O=16,0 ; H=1,00
expression littérale de la constante d'équilibre K associée : K= [HO - (aq)]éq/[Al(OH)4 -(aq)]éq. concentration molaire effective en ions hydroxyde [HO -]eq lorsque le précipité d'alumine trihydratée Al(OH)3(s) apparaît : [HO - (aq)]éq = K*[Al(OH)4 -(aq)]éq= Kc = 10-1 * 10-1 = 0,01 mol/L. valeur du pH de cette solution, notée pH1: [HO - (aq)]éq [H3O+ (aq)]éq =Ke = 10-14. H3O+ (aq)]éq =Ke /[HO - (aq)]éq = 10-14/0,01 = 1,0 10-12 mol/L soit pH1 = 12. Al(OH)3(s) apparaît dès que le pH est inférieur à la valeur pH1.
intérêt de la diminution du pH de la solution basique mise en œuvre dans l'industrie : la diminution du pH entraîne la précipitation de l'hydroxyde d'aluminium. intérêt de ce refroidissement : la solubilité de l'alumine tri-hydratée Al(OH)3(s) diminue lorsque la température diminue. Al(OH)3(s) précipite donc entierement à basse
température.
On note "4 n0" la quantité de matière initiale en ion Al3+.
expression littérale de la quantité d'électricité Q consommée par l'électrolyseur jusqu'à son état final Q= NA.e 12 xf = I Dt avancement final xfin de l'électrolyse : m= 1,08 t = 1,08 106 g 4xf= m/27 soit xf= m/(4*27) = 1,08 106/(4*27)= 104 mol. ordre de grandeur de la durée Dt en heures de l'électrolyse : Qté de matière d'électrons : 12 xf = 1,2 105 mol Dt = NA.e 12 xf / I = 105*1,2 105 / 105 = 1,2 105s = 1,2 105 /3600 heures voisin de 1,2 105 / 4 103 = 120/4=30 heures.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|