|
La
tomographie par émissions de positons ;
oscillateur
solide ressort ; le dihydrogène : : pile à combustible et électrolyse
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
La
tomographie par émissions de positons : 4 points .
" Les neurobiologistes disposent d'une panoplie de
techniques d'imagerie dont chacune révèle des aspects particuliers de
l'architecture et du fonctionnement du cerveau. […] La tomographie par
émissions de positions, TEP, […] donne accès aux variations du flux
sanguin, lesquels reflètent l'activité métabolique cérébrale, […].
De cette découverte a germé l'idée que l'on […] pourrait
observer de l'extérieur l'activité siégeant à l'intérieur du crâne.
En TEP, on détecte les molécules d'eau [présentes en grande
quantité dans le cerveau] en utilisant de l'eau radioactive que l'on
injecte au sujet par voie intraveineuse. […]. Dans ces molécules d'eau
radioactives, le noyau d'oxygène qui comprend normalement huit protons
et huit neutrons est remplacé par un noyau d'oxygène qui ne comporte
que huit protons et sept neutrons : c'est l'oxygène 15. L'oxygène 15
est un émetteur b+
: un de ses protons se transforme rapidement en neutron, en émettant un
positon(1) et un neutrino(2). "
D'après un article de la revue Pour la Science, N° 302,
décembre 2002.
(1) Le positon est aussi appelé positron.
(2) Le neutrino est une particule de symbole
Données numériques :
|
Noyaux et particules
|
166C
|
157N
|
158O
|
155F
|
Électron
|
Positon
|
Neutron
|
Proton
|
|
Énergie de liaison par nucléon (MeV.nucléon-1)
|
6,676
|
7,699
|
7,463
|
6,483
|
|
|
|
|
|
Masse (kg)
|
|
|
|
|
9,0910 -31
|
9,109 10 -31
|
1,674 92 10 -27
|
1,672 62 10 -27
|
Célérité de la lumière dans le vide : c = 2,998 10 8 m.s-1
1 eV = 1,602 10 -19 J
- La désintégration de l'oxygène 15
-Donner, en la justifiant, l'écriture symbolique X du noyau d'oxygène
15.
- Écrire l'équation de la réaction de désintégration du noyau d'oxygène
15, sans énoncer les lois de conservation et sans tenir compte de
l'émission du neutrino mentionné dans le texte. Le noyau fils n'est pas
produit dans un état excité.
- La variation d'énergie DE du système lors
de la désintégration d'un noyau d'oxygène 15 est indiquée sur la figure
1. Elle peut être calculée en utilisant le diagramme énergétique de
cette figure.
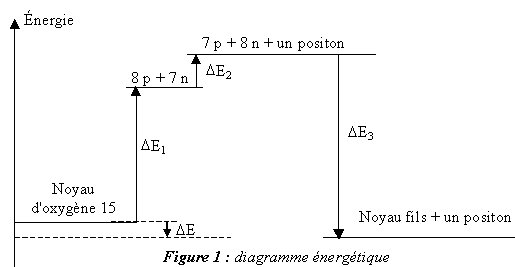
Définir l'énergie de liaison El du noyau.
On rappelle que l'énergie de liaison par nucléon est notée El/A
. Calculer, en MeV, la variation d'énergie DE1
indiquée sur la figure 1. Par un calcul identique on trouve D E1 = 111,9 MeV.
En utilisant les masses des particules, calculer, en MeV, la variation
d'énergie DE2 indiquée sur la
figure 1 (on donnera le résultat final avec deux chiffres
significatifs).
Déduire des résultats précédents la valeur, exprimée en MeV, de la
variation d'énergie D E du système lors de
la désintégration d'un noyau d'oxygène 15.
- L'utilisation de l'oxygène 15 en TEP
" Le positon est l'antiparticule de l'électron, […]. Matière et
antimatière s'annihilent(3) dès qu'elles sont en présence : un positon
et un électron du milieu environnant s'annihilent en libérant une paire
de photons d'énergie déterminée (511 kiloélectronvolts). Les deux
photons sont émis dans deux directions diamétralement opposées. […]
L'objet de la TEP est de repérer les photons […], très énergétiques,
[qui] traversent en grande partie le cerveau et le crâne, de sorte que
l'on peut les détecter en dehors de la boite crânienne. Le dispositif
de détection, la caméra à positons, […] entoure la tête du sujet. […]
Lorsqu'une paire de photons gamma de 511 kiloélectronvolts arrive
simultanément sur deux détecteurs […], on admet qu'ils sont issus de la
dématérialisation d'un même positon (figure 2). […]. Après l'analyse
mathématique, on obtient une série de " coupes " contiguës du cerveau
qui représentent la concentration en noyaux d'oxygène 15 en chaque
point ce qui reflète le débit sanguin local.
Enfin, le temps de demi-vie de ces noyaux d'oxygène 15 émetteurs de
positons est bref : 123 secondes. Cette propriété est importante dans
le contexte de l'utilisation de ces molécules chez l'homme, car, d'une
part l'irradiation subie par les sujets est faible et d'autre part
cette radioactivité disparaissant rapidement, on peut faire plusieurs
études chez le même sujet. Cette courte durée de vie impose néanmoins
que l'eau radioactive soit préparée dans les minutes qui précèdent son
injection, et que deux injections successives soient espacées de 8 à 10
minutes. "
(3) Annihiler : réduire à rien ; détruire, anéantir. En physique,
transformation intégrale de l'énergie de masse en énergie transportée
par une onde électromagnétique.
- Définir le temps de demi-vie t1/2 .
- L'évolution temporelle du nombre de noyaux d'oxygène 15 est donnée
par la loi de décroissance où N0 est le nombre de noyaux
d'oxygène 15 au moment de l'injection à l'instant de date t = 0 s. À
partir de cette loi, montrer que la constante radioactive l a pour expression : l
= ln 2 / t1/2 .
Calculer sa valeur.
- Si l'on souhaite poursuivre l'examen par TEP, on estime qu'il est
nécessaire de procéder à une nouvelle injection dans l'organisme du
patient lorsque le nombre N(t1) de noyaux d'oxygène 15
restant à l'instant de date t1 est de l'ordre de 5% du
nombre N0 de noyaux initialement injectés. Calculer la
valeur de la date t1.
- Justifier la durée d'espacement des injections évoquée dans le texte.
- La détection du rayonnement gamma
-En utilisant le texte, écrire l'équation de la réaction ayant lieu
lors de la rencontre d'un positon, issu de la désintégration d'un noyau
d'oxygène 15, avec un électron du milieu environnant. On notera g chaque photon gamma émis.
- On admet que l'énergie libérée par cette réaction est partagée
également entre les deux photons dont la masse est nulle. Calculer
l'énergie de chaque photon gamma émis. Est-elle en accord avec celle
donnée dans le texte (aucun calcul d'écart relatif n'est demandé.
corrigé
158O : n°atomique ou
nombre de charge Z=8
nombre de masse
A=15 ; nombre de protons Z= 8 ; nombre de neutrons : 15-8=7.
158O --> 157N + 01e
On appelle énergie de liaison notée El d'un noyau
l'énergie que doit fournir le milieu extérieur pour séparer ce noyau au
repos en ses nucléons libres au repos
DE1 = Énergie de liaison
par nucléon * nombre de nucléons = 7,463*15 = 111,94 MeV
DE2 : un proton se
transforme en neutron + émission d'un positon
DE2 =( masse neutron +
masse positon- masse proton )c²
DE2 = ( 1,674 92 + 9,109
10 -4 - 1,672 62 )10 -27 * (2,998
108)² = 2,89 10-13 J
2,89 10-13 / 1,6 10-19 = 1,8 106
eV = 1,8 MeV.
D E = DE3
+DE1 + DE2 ;
DE3 =
- El(157N )=-7,699*15 = -115,5 MeV
D E = -115,5+111,9+1,8 = -1,8 MeV.
Le temps de demi-vie t½
ou période est la durée au bout de laquelle la moitié des noyaux
initialement présents se sont désintégrés.
loi de écroissance radioactive : N = N0 exp(-lt) ou ln( N0 /N)= lt
pour t = t½ , N= ½N0 soit N0 /N =2: ln 2
= l t½.
l = ln2 / t½ = ln2 / 123 = 5,64 10-3 s-1.
calcul de t1 : pour t= t1, N=
0,05 N0 soit N0 /N = 20
ln( 20)= 5,64 10-3 t1 soit t1
= 531 s. (environ 9 minutes)
d'où la durée entre deux injections successives.
01e
+ 0-1 e --> 2 photons g.
Annihiler : transformation intégrale de l'énergie de masse en
énergie transportée par une onde électromagnétique.
soit 2* 9,109 10 -31 *(3 108)² = 1,64 10-13
J
1,64 10-13 / 1,6 10-19 = 1,024 106
eV pour deux photons
énergie d'un photon g : 5,12 105
eV = 512 keV ( en accord avec le texte)
|
|
oscillateur
solide ressort (5,5 points)
Le but de cet exercice est de vérifier l'accord entre
l'expérience et la théorie dans le cas des oscillations libres d'un
système solide-ressort horizontal.
Étude expérimentale :
Au laboratoire on filme, avec une caméra numérique, les
oscillations libres d'un solide de masse m. Ce solide est attaché à
deux ressorts identiques à spires non jointives, de constante de
raideur k1, et il est posé sur un banc à coussin d'air
horizontal (figure 1). m = 54,0 g, la masse des ressorts est
négligeable et k1 = 12,0 N.m-1.
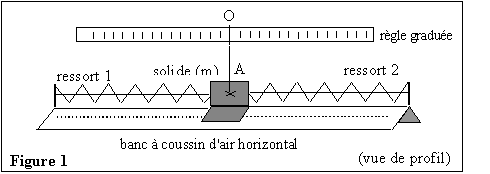
Les deux ressorts restent tendus pendant toute l'expérience.
Une règle graduée horizontale est placée à la verticale au dessus du
banc. Lorsque le système solide-ressorts est en équilibre, la
soufflerie du banc étant en fonctionnement, le point A repéré sur le
solide est à la verticale du zéro de la règle graduée (figure 1). On
écarte alors le solide vers la gauche et on l'abandonne sans vitesse
initiale. Le point A oscille entre les positions B et C ; on filme les
oscillations (figure 2).
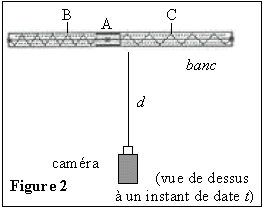
La fréquence d'enregistrement des images est égale à 25 images
par seconde. La caméra est placée dans le même plan horizontal que le
banc, à une distance d de celui-ci, grande devant la distance BC. Son
axe optique (ou axe de visée) en pointillés sur la figure 2 est
perpendiculaire au banc et passe par A lorsque le système est à
l'équilibre.
Un logiciel approprié permet de pointer les différentes
positions du point A sur l'écran vidéo entre ses deux positions
extrêmes B et C.
On commence le pointage un peu avant le premier passage du
point A à la verticale du point O et on le poursuit un peu après son
troisième passage à la verticale du point O. Le fichier de données est
transféré vers un tableur qui permet de modéliser et d'afficher la
courbe x = f(t), x étant l'abscisse du point A par rapport à l'origine
O. On obtient le graphe n°1 :
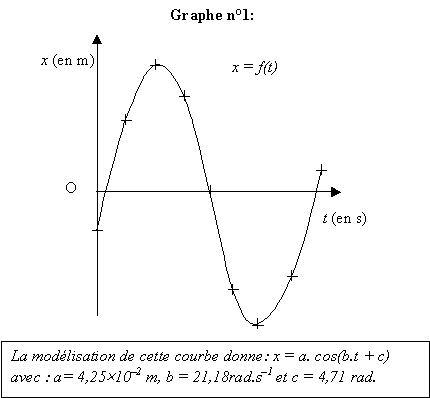
L'origine des dates t = 0 s correspond au passage du point A à
la première position enregistrée.
- Étude théorique du mouvement du solide : dans cette étude
tous les frottements sont négligés.
On peut modéliser un oscillateur mécanique horizontal par un système
solide-ressort constitué d'un solide de masse m, fixé à l'extrémité
d'un seul ressort à spires non jointives, de masse négligeable et de
constante de raideur k.
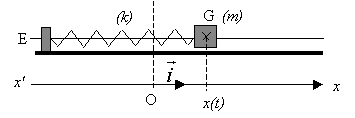
La position du centre d'inertie G du solide est étudiée
dans un référentiel terrestre considéré comme galiléen et repérée par
son abscisse x(t) sur un axe horizontal x'Ox. L'origine des abscisses
correspond à l'abscisse de G lorsque le solide est à l'équilibre. Le
solide est mis en oscillation. La période propre des oscillations est T0.
- Forces exercées sur le solide en mouvement. On note T la force
exercée par le ressort sur le solide. Pour une position quelconque du
solide, nommer les trois forces qui s'exercent sur ce solide. Les
représenter au centre d'inertie G, sans souci d'échelle, sur le schéma
n°1.
En rappelant l'expression du vecteur force T en fonction de
l'allongement x, vérifier mathématiquement que cette force a bien le
sens attendu lorsque le centre d'inertie G se trouve à droite de la
position d'équilibre sur le schéma n°1.
- Équation différentielle du mouvement du solide. En appliquant la
deuxième loi de Newton au solide, établir l'équation différentielle du
mouvement de son centre d'inertie G.
Sachant que la solution générale de l'équation différentielle est de la
forme : x(t) = Xmax cos ( 2p/T0
t + j) montrer que l'expression de la
période propre T0 de l'oscillateur est : T0 = 2p(m/k)½.
-Vérifier l'homogénéité de l'expression de la période propre T0
par une analyse dimensionnelle.
- Retour à l'expérience : on rappelle qu'il est
équivalent dans cette étude de considérer le mouvement d'un point A
quelconque repéré sur le solide en translation ou celui du centre
d'inertie G du solide.
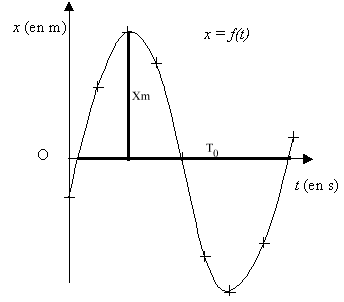
- Représenter les grandeurs expérimentales T0exp et Xm,exp
par des segments en trait épais sur chacun des deux axes de la courbe x
= f(t) (graphe n°1).
- Déterminer les valeurs expérimentales de l'amplitude Xm,exp
et de la période propre T0exp des oscillations du mouvement
du solide à partir du résultat de la modélisation de la courbe.
Justifier.
- Les deux ressorts de constante de raideur k1 sont
équivalents à un seul ressort de raideur k = 2k1.
L'expression de la période propre T0 trouvée dans l'étude
théorique reste valable dans le cas de deux ressorts initialement
tendus. Calculer à partir des résultats de l'étude théorique la période
propre T0 des oscillations.
- Comparer les deux valeurs de la période propre en calculant l'écart
relatif
- Aspect énergétique en l'absence de frottements : le
système solide-ressort est toujours supposé osciller sans frottement.
Dans le modèle d'oscillateur adopté, le choix des états de référence
est tel que l'énergie potentielle de pesanteur est nulle à l'altitude
du centre d'inertie G ; l'énergie potentielle élastique est nulle
lorsque l'allongement du ressort est nul.
- Rappeler l'expression de l'énergie mécanique Em du système
solide-ressort horizontal dans le champ de pesanteur à la position
d'abscisse x quelconque, en fonction de m, k, x et v la valeur de la
vitesse du centre d'inertie G dans le référentiel terrestre.
- Soit Vm la valeur maximale de la vitesse atteinte par le
centre d'inertie G pour les oscillations d'amplitude Xm
étudiées. En traduisant la propriété de l'énergie mécanique, montrer
que : Vm = 2p Xm/T0.
- Calculer la valeur de la vitesse maximale du mobile pour une
amplitude de 4,3 cm et une période propre de 0,30 s.
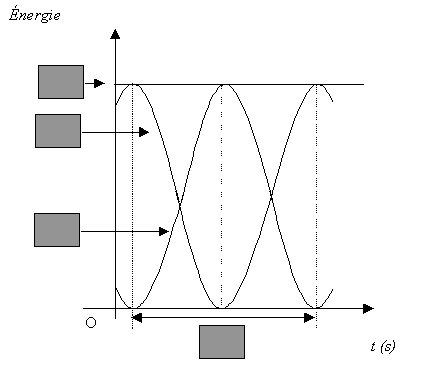
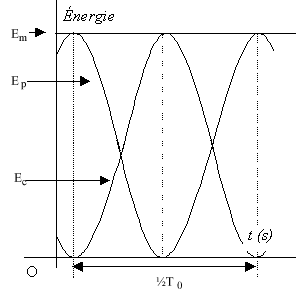
- En vous aidant du graphe n°1, indiquer dans les cases
grisées du graphe n°2 la durée désignée par la double flèche, en
fonction de T0 ; les énergies : Em, EP
(énergie potentielle élastique) et EC (énergie cinétique).
- Aspect énergétique en présence de frottements : Le
système solide-ressort est toujours supposé osciller, mais désormais on
tient compte des frottements.
- De quel régime s'agit-il dans le cas où l'on observe toujours des
oscillations bien que l'on ne puisse plus négliger les frottements ?
Comment nomme-t-on le temps caractéristique T correspondant ?
- Soit Em0 la valeur de l'énergie mécanique de l'oscillateur
lâché sans vitesse initiale avec un allongement maximum initial Xm0.
Établir l'expression de l'énergie mécanique Em0 en fonction
de l'allongement maximum initial Xm0.
On constate expérimentalement qu'au bout d'une oscillation, l'amplitude
du mouvement est divisée par r (nombre réel positif non nul). Établir
l'expression du rapport de l'énergie mécanique correspondante Em1
à l'énergie mécanique initiale Em0 en fonction de r.
corrigé
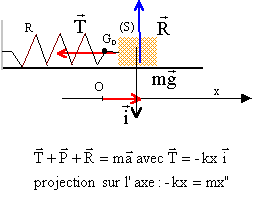
ou encore x" +
k/m x= 0 avec w 0² = k/m
le solide est
soumis à son poids, à l'action du support et à la tension du ressort.
Le vecteur T et le vecteur unitaire xi sont colinéaires et de sens
contraire (si x est positif, T est dirigée vers la gauche, ressort étiré ; si
x est négatif T est dirigé vers la droite,
ressort comprimé) : la tension est une force de rappel qui tend à
ramener le ressort vers sa position d'équilibre x=0 en O.
w 0=2p/
T 0 soit T 0 =
2p/w 0 d'après
la solution de l'équation différentielle
or w 0 = ( k/m)½ d'où T0
= 2p( m/k)½ .
2p : sans dimension ; masse en kg
; raideur k : force (N) / longueur (m) = masse(kg) * accélération (ms-2)
/ longueur(m)
m/k est donc homogène à un temps au carré soit ( m/k)½
homogène à un temps.
amplitude a = Xmax = 4,25 10-2 m
pulsation w 0 = b =
21,18 rad.s-1 ; T 0 =
2p/w 0 = 2*3,14 / 21,18 = 2,96 10-1s.
Le calcul donne : w 0²
= 2k/m = 2*12/0,054 =
444,4 soit w 0 = 21,08
rad/s
période calculée : 2*3,14 / 21,08 = 2,98 10-1 s.
écart relatif : (0,298-0,296) / 0,297 *100= 0,7 %
énergie mécanique Em
du système solide-ressort horizontal :
énergie cinétique
de translation + énergie potentielle élaxtique soit Em= ½mv²
+ ½kx²
si x = Xm
l'énergie mécanique est sous forme potentielle élastique : ½kX²m.
si x=0, l'énergie
mécanique est sous forme cinétique : ½mV²m.
en absecence de
frottement, l'énergie mécanique se conserve : ½kX²m= ½mV²m.
V²m=k/mX²mavec
T²0 = 4p²( m/k) soit k/m = 4p²/ T²0 d'où Vm
= 2p Xm/T0.
Vm = 2*3,14*4,3 10-2/0,3 = 0,90 m/s.
régime pseudo-périodique dans le cas où l'on observe toujours
des oscillations bien que l'on ne puisse plus négliger les frottements
; T : pseudo-période
Em0 = ½k X²m0
Au bout d'une oscillation, l'amplitude du mouvement est
divisée par r : X²m0 est donc divisée par r²: X²ml =
X²m0 /r² ;
Eml = ½k X²ml ; Eml = ½k X²m0
/r² ; Em1 = Em0 / r².
|
|
dihydrogène : pile à combustible et électrolyse( 6,5 points)
Les parties 1 et 2 sont indépendantes
Le principe de la pile à combustible, une technique déjà
ancienne, consiste à utiliser du dihydrogène pour stocker et
transporter l'énergie. En effet le dihydrogène semble être le carburant
par excellence pour les véhicules du futur, face aux préoccupations
environnementales croissantes.
Une pile à combustible est un assemblage de cellules
élémentaires, en nombre suffisant pour assurer la production
électrochimique d'électricité dans les conditions de tension et
d'intensité voulues.
Principe de fonctionnement d'une
cellule élémentaire
De façon générale, le fonctionnement électrochimique d'une
cellule élémentaire de pile à combustible peut être schématisé selon le
schéma :
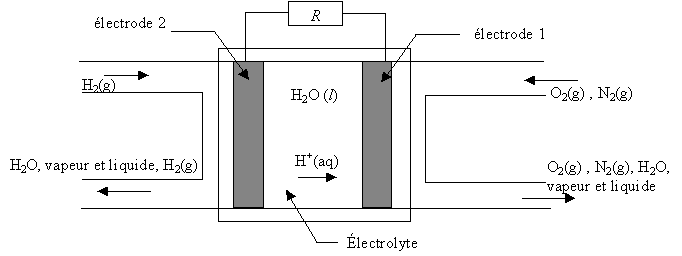
Chaque cellule élémentaire est constituée de deux
compartiments disjoints alimentés chacun en gaz réactifs dioxygène et
dihydrogène. Les deux électrodes sont séparées par l'électrolyte,
solution qui laisse circuler les ions. Du platine est inséré dans les
deux électrodes poreuses.
- Pour cette pile acide, les équations des réactions aux
électrodes s'écrivent :
H2(g) = 2 H+(aq) + 2 e-
O2(g) + 4 H+(aq) + 4 e-
= 2 H2O(l)
Des deux gaz réactifs préciser quel est le réducteur et quel est
l'oxydant. Justifier la réponse.
Montrer que l'équation de la réaction globale de fonctionnement s'écrit
: 2 H2(g) + O2(g) = 2 H2O(l)
- Pour l'environnement quel est l'avantage d'une pile à
combustible utilisant le dihydrogène par rapport à un carburant
classique ?
- Des électrodes 1 ou 2, quelle est celle appelée " cathode "
? Justifier.
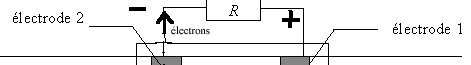
- Indiquer sur le schéma le sens de circulation des
électrons. En déduire à quelle électrode correspond le pôle positif de
la pile et à quelle électrode correspond le pôle négatif.
- Le platine inséré dans les deux électrodes poreuses joue le
rôle de catalyseur. Définir un catalyseur.
- Une cellule élémentaire fonctionne pendant une durée Dt = 192 h et débite un courant d'intensité
considérée constante I = 300 A. En utilisant les équations des
réactions se produisant aux électrodes, calculer la quantité de matière
de chacun des gaz réactifs nécessaire au fonctionnement d'une cellule
élémentaire.
On donne la constante d'Avogadro NA = 6,021023 mol-1
, la charge électrique élémentaire e = 1,6 10 -19 C.
Principe de production du dihydrogène
par électrolyse au laboratoire :
Une pile à combustible, pendant les phases de production, doit
être alimentée en continu par du combustible, la plupart du temps du
dihydrogène, et en comburant, le plus souvent du dioxygène, présent à
près de 20 % dans l'air ambiant.
Le dihydrogène n'est pas une source d'énergie naturelle. Il
faut produire du dihydrogène en émettant le moins de pollution
possible. Plusieurs possibilités sont étudiées : à partir de carburants
fossiles, de biomasse, d'algues vertes ou de bactéries, de
l'électrolyse de l'eau. L'électrolyse peut se concevoir comme un moyen
de production simple mais coûteux.
- Au laboratoire on peut produire du dihydrogène en
électrolysant une solution aqueuse de sulfate de sodium de
concentration molaire en soluté apporté c = 1,0 mol.L-1.
Pour obtenir cette solution, on dissout le sulfate de sodium Na2SO4(s)
dans de l'eau distillée. Le volume de solution obtenue est V = 500 mL.
Écrire l'équation de la réaction de dissolution du sulfate de sodium
solide.
- Compléter littéralement, en fonction de c, V et xf le
tableau descriptif de l'évolution du système au cours de la
transformation chimique.
- Sachant que dans l'état final de la transformation la quantité de
matière d'ions sodium obtenue est de 1,0 mol en déduire l'avancement
final de la réaction. La transformation est-elle totale ?
- Donner l'expression du quotient de réaction Qr, f
dans l'état final du système. Calculer sa valeur.
- On réalise le montage schématisé ci-dessous :
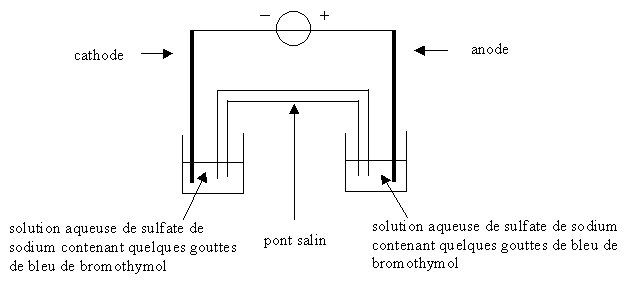
Deux petits cristallisoirs sont remplis de la solution
aqueuse de sulfate de sodium précédente à laquelle on a ajouté quelques
gouttes de bleu de bromothymol. Ils sont reliés l'un et l'autre par un
pont salin. Les deux électrodes, respectivement dans chacun des deux
cristallisoirs, sont reliées à un générateur de tension. Avant de
mettre en fonctionnement le générateur, on observe que les deux
solutions contenues dans les cristallisoirs sont vertes. Une fois
l'électrolyse lancée, on observe que les solutions contenues dans les
cristallisoirs prennent des teintes différentes.
On donne pour le bleu de bromothymol : zone de virage : 6,0 - 7,6 ;
teinte jaune pour la forme acide ; teinte bleue pour la forme basique.
Les deux réactions ayant lieu aux électrodes ont pour équations : 2 H2O(l)
= O2(g) + 4 H+(aq) + 4 e-
2 H2O(l) + 2 e- = H2(g) + 2 HO -
(aq)
- Quelle est la réaction qui a lieu à l'anode ? Quelle est la réaction
qui a lieu à la cathode ?
- Quelle couleur prend la solution du côté de la cathode ? du côté de
l'anode ?
- Écrire l'équation de réaction qui a lieu lors de l'électrolyse.
- L'électrolyse terminée on transvase dans un becher les deux
solutions contenues dans chacun des cristallisoirs. Théoriquement,
quelle sera la teinte finale de la solution obtenue ? Justifier par un
raisonnement qualitatif à l'aide des quantités de matière. En fait le
dioxyde de carbone dissous dans l'eau distillée peut modifier la teinte
théorique attendue.
corrigé
2H2(g) = 4 H+(aq)
+ 4 e- : le réducteur H2 s'oxyde
O2(g) + 4 H+(aq) + 4 e- = 2 H2O(l)
: l'oxydant O2 se réduit
Faire la somme, dans le bilan les électrons n'apparaissent pas : 2 H2(g)
+ O2(g) = 2 H2O(l)
La réaction libère de l'eau non polluante alors que les gaz
d'échappement actuels libèrent du CO2, qui participe à
l'effet de serre, des oxydes d'azote.
électrode 1 : cathode, réduction de O2 ; électrode
2 : anode, oxydation de H2, libérant des électrons.
catalyseur : espèce chimique qui augmente la vitesse de
réaction ; il n'apparaît pas dans le bilan de l'équation.L'avancement
final de la transformation est atteint plus rapidement sans être
modifié.
Quantité d'électricité : Q = I Dt
= 300/192*3600 = 2,07 108 C
La charge d'une mole d'électrons est, en valeur absolue 96500
C d'où la quantité de matière d'électrons :
n(électrons) = 2,07 108 /96500 = 2,15 103
mol.
H2(g) = 2H+(aq) + 2 e- : n(H2)
= ½ n(électrons)= 1,07 103 mol.
O2(g) + 4 H+(aq) + 4 e- = 2 H2O(l)
: n(O2) = 0,25 n(électrons)= 5,37102
mol.
Na2SO4(s) = 2 Na+ (aq) + SO42-
(aq)
|
Na2SO4(s)
|
=2 Na+
(aq)
|
+ SO42-
(aq)
|
|
initial
|
cV
|
0
|
0
|
|
en cours
|
cV-x
|
2x
|
x
|
|
final
|
cV-xf
|
2xf
|
xf
|
Si la transformation est totale, le sulfate de sodium est totalement
consommé : cV-xmax =0 ; xmax = cV = 0,5 mol
xf =½
qté de matière finale Na+= 0,5 mol
xmax =xf
: donc la transformation est totale.
Qr, f =[Na+]²f[
SO42-]f avec : [Na+]f
=2xf/V et [ SO42-]f =xf/V ; Qr, f = 4
(xf/V)3 = 4*(0,5/0,5)3=4.
à l'anode oxydation de l'eau : 2 H2O(l) = O2(g)
+ 4 H+(aq) + 4 e-
le milieu devient acide, donc teinte jaune.
à la cathode, réduction de l'eau 4 H2O(l) + 4 e-
= 2H2(g) + 4 HO - (aq)
le milieu devient basique, donc teinte bleue.
or 4 H+(aq) +4 HO - (aq) = 4 H2O(l)
d'où le ilan : 2 H2O(l) = 2H2(g)
+ O2(g).
L'oxydation produit 4 protons H+(aq) alors que la réduction
produit 4 anions hydroxyde HO-(aq). Ces ions réagissent pour
former de l'eau et, en conséquence, le milieu doit être neutre; la
solution aura une teinte verte (teinte sensible du BBT).
|
|
retour -menu
|











