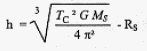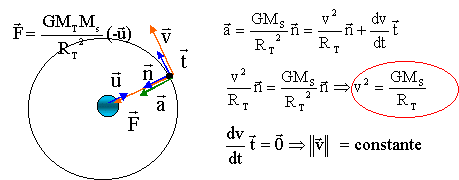|
utiliser
le beurre pour dissoudre une tache de graisse d'après bac Afrique 2005 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
Partie I : la fusion nucléaire contrôlée : Depuis plusieurs années des recherches sont menées en Europe sur les réactions de fusion nucléaire contrôlées. Elles concernent principalement les isotopes de l'hydrogène : le deutérium et le tritium. Le mélange réagissant doit être porté à très haute température, d'où l'expression énergie thermonucléaire désignant l'énergie libérée dans ce type de réaction. A long terme, l'énergie thermonucléaire pourra remplacer l'énergie des centrales à fission actuelles.
On représente le noyau de l'atome X par le symbol AZX.
II. Réactions nucléaires : Actuellement des recherches sont menées sur un mélange deutérium-tritium ; plusieurs réactions nucléaires sont possibles. Par exemple avec deux noyaux de deutérium, on peut avoir la réaction (1) : 21H+ 21H --> A1Z1X+ neutron ou la réaction (2) :21H+ 21H --> A2Z2X+ proton. Pour chacune de ces réactions (1) et (2) donner le nom et le symbol des noyaux formés : A1Z1X et A2Z2X III. Conditions : Pour qu'une réaction de fusion puisse se produire entre deux
noyaux, il faut qu'ils soient très proches. Il faut vaincre leur
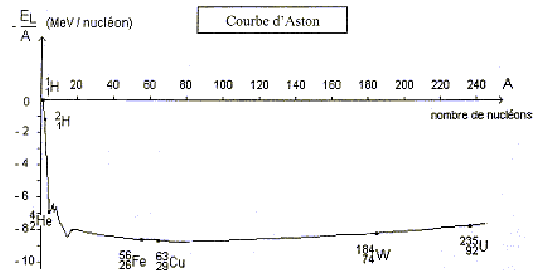
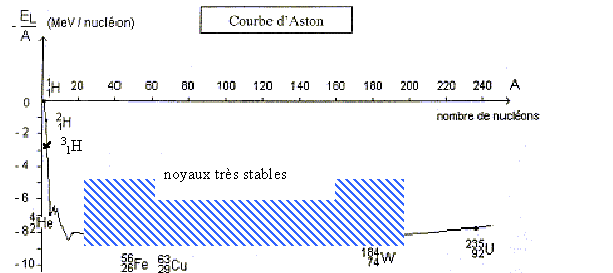
répulsion coulombienne. Explique l'expression " répulsion coulombienne". IV Courbe d'Aston : Au cours des chocs, les noyaux sont dissociés en nucléons séparés puis de nouveaux noyaux sont formés.Il faut donc fournir de l'énergie aux noyaux pour se dissocier. Cette énergie comptée positivement est au moins égale à l'énergie de liaison des noyaux. Plus le noyau contient de nucléons, plus l'énergie de liaison est importante.
V. Bilan énergétique : montrer que l'énergie libérée par la réaction (3) vaut 17,6 meV. Partie II : électrolyse de l'eau : La production d'hydrogène en vue d'une utilisation énergétique semble avoir de l'avenir, que ce soit avec les piles à combustibles ou les moteurs à combustion interne. Le dihydrogène peut être produit par électrolyse. L'objet de cet exercice est d'en étudier la production. Dans l'industrie on utilise de l'eau pure afin d'éviter que des impuretés perturbent le fonctionnement de l'électrolyse. La cellule d'électrolyse ou électrolyseur est constituée de deux électrodes ( cathode et anode) et d'un électrolyte ; un générateur de tension continue maintient une tension de l'ordre de 2 V permettant d'avoir une intensité du courant électrique de plusieurs kiloampères. L'équation de la réaction qui a lieu est : 2H2O(l)= 2H2(g) + O2(g). I étude de l'électrolyse :
II. intensité du courant dans l'électrolyseur : A l'instant t0=0 on démarre l'électrolyse. On cherche à connaître l'intensité du courant I qui circule dans l'électrolyseur et qui permet d'avoir une production horaire de dihydrogène de 5 m3. A un instant t, la valeur absolue de la charge électrique Q transportée dans l'électrolyseur est donnée par la relation Q=I(t-t0)
Deux isotopes ne diffèrent que par leur nombre de neutrons. la composition du noyau de deutérium : un proton et un neutron un isotope du deutérium : tritium : un proton et deux neutrons ou encore hydrogène : un proton et zéro neutron.
conservation de la charge : 1+1 = Z1 soit Z1=2 (X est : hélium He) conservation du nombre de nucléons : 2+2=A1+1 soit A1=3 21H+ 21H --> A2Z2X+ 11H conservation de la charge : 1+1 = Z2 +1 soit Z2=1 (X est : élément hydrogène H) conservation du nombre de nucléons : 2+2=A2+1 soit A2=3
( isotope : tritium)
La charge des
noyaux de deutérium et de tritium est positive.
El = (2 mN + mP - m(31H)) c² variation de masse en u : 2 mN + mP - m(31H) = 2*1,008 66 + 1,007 28-3,015 50 = 9,1 10-3 u énergie de masse de l'unité de masse atomique :931,5 MeV El = 9,1 10-3 *931,5 = 8,48 MeV.
Energie de liaison d'un noyau de tritium : environ 2,8 MeV par nucléon soit 3*2,8 = 7,4 MeV Energie de liaison d'un noyau de deutérium : 1 MeV par nucléon (soit environ 2 MeV). Energie de liaison de d'hélium : environ 7 MeV par nucléon (soit environ 28 MeV). La somme des énergies de liaison des réactifs ( environ 10 MeV) est inférieure à l'énergie de liaison des produits ( 28 MeV) La réaction de fusion (3) libère donc de l'énergie, environ 18
MeV.
Dm = m(42He)+ m(10n)- m(21H) - m( 31H) Dm = 4,00150+1,00866-2,01355-3,01550= -1,89 10-2 u énergie de masse de l'unité de masse atomique : 931,5 MeV énergie libérée : -1,89 10-2*931,5 = -17,6 MeV.
2H+(aq)+ 2e- = H2(g) réduction se produisant à la cathode négative. la réduction nécessite un apport d'électrons ; la cathode est reliée au pôle négatif du générateur. relation entre la quantité de matière de dihydrogène formé n(H2) et l'avancement x : n(H2)= x relation entre la quantité d'électrons ne mis en jeu et l'avancement x : ne = 2x l'expression de la valeur absolue de la charge électrique Q et l'avancement x : Q= 2F x l'intensité I du courant : Q= I(t-t0) = 2F x = 2Fn(H2) d'où : I= 2F n(H2) /(t-t0) n(H2) = volume (L) / volume molaire (L/mol) = 5000 / 25 = 200 mol. (t-t0) = 1 h = 3600 s ; 1 F= 9,65 104 C/mol. I= 2*9,65 104 * 200 / 3600 = 1,1 104 A.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
En Juillet 2004, la sonde européenne Cassini-Huygens nous a livré les premiers clichés des anneaux de Saturne. Elle a également photographié Titan, le plus gros satellite de Saturne, situé à une distance RT de Saturne. L'excentricité orbitale des satellites étant très faible, on supposera leurs trajectoires circulaires. Dans tout l'exercice on se place dans le référentiel saturno-centrique, centré sur Saturne et dont les trois axes sont dirigés vers trois étoiles lointaines supposées fixes. On considère que saturne et ses satellites sont des corps dont la répartition de masse est à symétrie sphérique. Les rayons des orbites des satellites sont supposés grands devant leur taille. G= 6,67 10-11 SI ; rayon de l'orbite de Titan RT= 1,22 106 km ; rayon de la planète Saturne RS= 6,0 104 km ; période de rotation de Saturne sur elle même TS= 10 h 39 min. Masse de Saturne : MS= 5,69 1026 kg. I Quelques caractèristiques de Titan :
II. D'autres satellites de Saturne : après le survol de Titan, la sonde cassini a survolé le satellite Encelade en février 2005 On peut considéré que dans le référentiel Saturno-centrique, Encelade a un mouvement de révolution circulaire uniforme, dont la période ( en jour terrestre) est TE= 1,37 et le rayon est RE.
III Sonde saturno-stationnaire : on cherche dans cette partie de l'exercice à déterminer l'altitude h à laquelle devrait se trouver la sonde Cassini pour être saturno-stationnaire ( immobile au dessus d'un point de l'équateur de Saturne)
corrigé Titan est soumis à la seule force gravitationnelle exercée par Saturne.
Dans le référentiel saturno-centrique écrire la seconde loi de Newton, appliquée à Titan, ( assimilé à son centre d'inertie T). l'accélération vectorielle et la force gravitationnelle sont colinéaires et de même sens : l'accélération est donc centripète et sa composante tangentielle est nulle. alors dv/dt =0
entraîne v= constante. Le mouvement est uniforme.
élever l'expression de la période au carré : T²= 4p2RE2/v2 ; remplacer v² par son expression : T²= 4p2RE3/(GMS) soit T² / RE3 = 4p2 / (GMS) 3ème loi de Kepler. RE3 = T² GMS / (4p2) avec T= 1,37*24*3600 = 1,1837 105 s RE3 = (1,1837 105)2 * 6,67 10-11*5,69 1026 / (4*3,14²)=1,348 1025 m3. prendre la racine cubique : RE= 2,38 108 m.
La période de révolution de la sonde TC doit être ègale à la durée d'un jour sur Saturne. ecrire la 3ème loi de Kepler avec R= RS+h ( RS+h)3 = TS ² GMS / (4p2) RS+h= racine cubique [TS ² GMS / (4p2)] = [TS ² GMS / (4p2)] 1/3. h= [TS ² GMS / (4p2)] 1/3- RS. RS= 6,0 107 m ; TS= 10 h 39 min = 10*3600+39*60 =3,834 104 s ; MS= 5,69 1026 kg. h= [(3,834 104)2* 6,67 10-11*5,69 1026 / (4*3,14²)] 1/3-6,0 107. h= [1,415 1024] 1/3-6,0 107= 1,12 108 -6,0 107=5,2 107 m.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
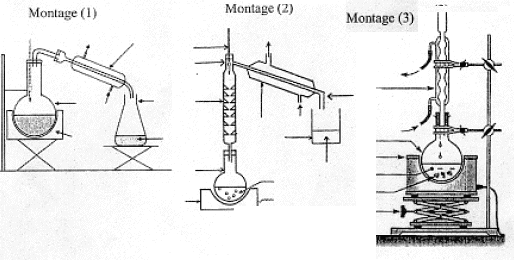
A travers les quatre parties abordées, nous allon essayer de comprendre les étapes de fabrication d'un savon à partir d'un morceau de beurre, dans le but de dissoudre une tache de graisse à la surface d'un tissu. I. Fabrication d'un ester à partir d'un acide carboxylique. L'acide butyrique, composé A, est un acide carboxylique de formule semi-développée CH3-CH2-CH2-COOH. Dans la nomenclature officielle, le nom de l'acide butyrique est acide butanoïque.
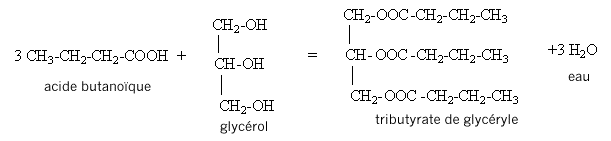
II. Synthèse d'un corps gras : la butyrine. La butyrine, appelée aussi tributyrate de glycéryle, est un corps gras ( ou triester) présent dans le beurre. Cette molécule résulte de l'action de l'acide butyrique sur le glycérol de formule semi-développée : 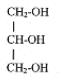
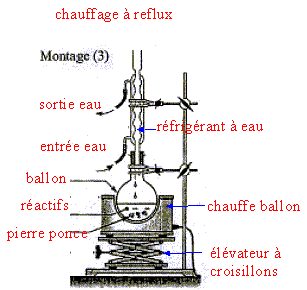
III. Fabrication d'un savon mou à partir du beurre : Le beurre contient plusieurs corps gras, l'oléine, la palmitine et la butyrine. La butyrine représente 35 % en masse du beurre. Nous n'étudierons que la fabrication du savon à partir de la butyrine. Pour cela nous allons faire réagir 20 g de beurre avec un excès de potasse ( K+ + HO-) concentrée. Après 30 min de chauffage, on observe après relargage, la formation d'un précipité jaune.
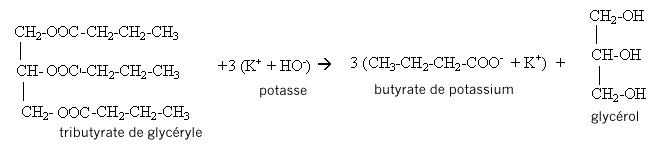
IV. Utilisation du savon fabriqué pour dissoudre une tache de graisse : Après élimination de l'excès de potasse, on souhaite étudier les qualités détergentes du savon sur une tache de graisse. Le savon est composé d'ion carboxylates qui peuvent être modélisés des deux façons suivantes :  Le schéma ci-dessous représente une tache de graisse à la surface d'un tissu plongé dans l'eau savonneuse ( étape n°1) et sa dislocation par action du savon synthétisé précédemment (étape n°2) 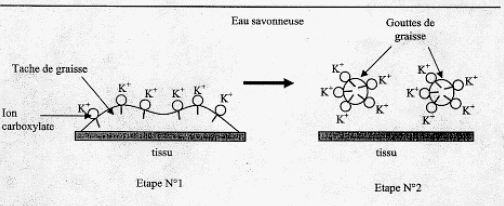 En vous aidant du shéma précédent, identifier la composition et la propriété de chacune des deux parties de l'ion carboxylate modélisé. corrigé le groupe caractéristique d'un acide carboxylique est le groupe carboxyle COOH : CH3-CH2-CH2-COOH. L'action de l'acide butanoïque sur un alcool, le propan-1-ol CH3-CH2-CH2-OH conduit à la formation d'un ester ( noté C) , le butanoate de propyle et à de l'eau ( notée D).
Qté de matière d'acide butyrique : n1 (mol = masse (g) / masse molaire (g/mol) = 39,6 / 88,0 = 0,450 mol. D'après les coefficients de l'équations bilan, 0,450 mol d'acide butyrique peut réagir avec 0,150 mol de glycérol : donc les réactifs sont en proportions stoechiométriques.
D'après les coefficients de l'équation, la quantité de matière (mol) de triester est égale à la quantité de matière (mol) de glycérol : on peut donc espérer obtenir au plus 0,150 mol de triester. soit une masse (g) = masse molaire (g/mol) * Qté de matière (mol) = 302*0,150 = 45,3 g. rendement = masse réelle obtenue(g) / masse théorique (g)
prévue = 29/45,3 = 0,640 (64,0%).
Dans 20 g de beurre il n'y a que 20*0,35 = 7 g de butyrine soit masse (g) / masse molaire (g/mol) = 7/302=2,317 10-2 mol D'après l'équation de la saponification on peut espérer obtenir au plus 3*2,317 10-2 = 6,95 10-2 mol de savon en tenant compte du rendement de la saponification : 6,95 10-2*0,85 = 5,91 10-2 mol de savon masse de savon
(g) = Qté de matière (mol) * masse molaire (g/mol)=126*5,91 10-2
= 7,4 g.
partie 2 : groupe (- COO-)est lipophobe et hydrophyle. La partie lipophile du savon se fixe sur la goutte de graisse ( ou de corps gras) ; par son extrémité hydrophile, le savon entraîne la goutte de graisse ( ou du corps gras) dans l'eau. |
||||||||||||||||||||||||||||||||||||||||||||||
|
|