On dose une espèce chimique A à l'aide d'une espèce chimique B:
- Au passage par l'équivalence on change de réactif limitant.
- A l'équivalence on a toujours : Quantité de matière (mol) de A dosé = Quantité de matière(mol) de B ajouté.
- La réaction qui sert de support au dosage doit être totale
- A l'équivalence les espèce A et B sont majoritaires
On étudie la transformation chimique totale dont l'équation est :
4 Al + 3 O2 --> 2 Al2 O3 état initial 16 mol 9 mol 0 mol en cours 16-4x 9-3x 2x état final 4 mol 0 mol 6 mol - Qté de matière de dioxygène dans l'état final = 4 mol
- Qté de matière d'aluminium dans l'état final = 0 mol
- Qté de matière d'oxyde d'aluminium dans l'état final = 6 mol
- le dioxygène est le réactif limitant
La conductivité molaire ionique :
----> aide :
le conductimètre indique soit :
- la conductivité en siemens par mètre
- la conductance qui elle dépend de la sonde de mesure- s'exprime en S m^ -2 mol
- s'exprime en S m^ 2 mol ^ -1.
- dépend du conductimètre utilisé pour la mesurer
- à température constante, ne dépend que du type d'ions présents en solution
à propos du couple ion permanganate / ion manganèse II :
----> aide
ion permanganate : forme oxydante qui va se réduire
ion manganèse II: forme réduite qui peut s'oxyder
MnO4(-) + 8H(+) + 5 électrons = Mn(2+) + 4H2O- L'ion permanganate peut être oxydé en ion manganèse II
- l'ion permanganate est la forme oxydante du couple.
- la demi-équation met en jeu 3 électrons
- la demi-équation met en jeu 5 électrons
Pour argenter un objet métallique on réalise une électrolyse. On le place dans une solution de nitrate d'argent[Ag(+) et NO3(-)] où il joue le rôle d'une des électrodes. L'autre électrode est en argent. On souhaite déposer 1,1 g d'argent sur cet objet. L'intensité du courant est constante et vaut I= 2 A.
Données : 1 F=96500 C et m(Ag) = 110 g/mol.
----> aide :
cathode négative : réduction de l'ion Ag(+)+ 1 électron = Ag (s)
anode positive( dite "anode soluble") : oxydation du métal Ag(s) = Ag(+) + 1 électron
Quantité d'électricité = I( A) * temps (s) = Qté de matière électrons (mol)*96500
Qté de matière électrons = Qté de matière argent déposé = 1,1 / 110 = 0,01 mol- La réaction se produisant à la cathode est Ag(s) =Ag(+) +1 électron
- L'équation globale de l'électrolyse est : Ag ( anode) + Ag(+) = Ag( dépôt) +Ag(+)
- Lorsque le dépôt est réalisé l'avancement est 0,01 mol
- La durée de l'électrolyse est 965 s
On effectue l'électrolyse d'une solution aqueuse de nitrate de plomb [Pb(2+) et 2 NO3(-)] avec des électrodes inattaquables. Les ions nitrate ne réagissent pas. Il se forme un dépôt de plomb et un gaz qui ravive une allumette incandescente sur l'autre électrode.
----> aide :
réduction à la cathode : Pb(2+ ) + 2 électrons = Pb(métal)
oxydation de l'eau à l'anode : H2O = ½O2 + 2H(+) + 2 électrons- Il se forme du dioxyde de carbone au cours de cette électrolyse.
- L'équation globale de l'électrolyse est : Pb(2+ ) + H2O = Pb(s) +½O2(g) + 2H(+)
- la dépôt s'effectue à la cathode
- L'électrolyse s'arrête si [Pb(2+)] =0 mol/L
On réalise les demi-piles Zn(2+) / Zn et Cu(2+) / Cu. Chaque demi-pile contient 100 mL de solution de concentration 0,1 mol/L. Le zinc et le cuivre des électrodes sont en excès. On considère la réaction Zn(2+) + Cu(s) = Zn(s) + Cu(2+) dont la constante d'équilibre est K= 2 10^ -37.
----> aide : quotient de réaction Q=[Cu2+] / [Zn2+]
si la valeur initiale du quotient de réaction est supérieure à la constante K, alors évolution spontanée en sens inverse ( droite vers la gauche)
pour une pile : anode négative ( oxydation du zinc) et cathode positive- La valeur initiale du quotient de réaction vaut 1
- Le système évolue dans le sens de la formation de Zn(s)
- à l'extérieur de la pile les électrons circulent de l'anode vers la cathode
- le zinc constitue la borne négative de la pile
Soit la réaction d'équation : 2H2O = H3O(+) + HO(-)
- elle peut être considérée comme une réaction acido-basique
- La constante de réaction vaut 10^ -14 à 25 °C
- on la nomme autoprotolyse de l'eau
- elle n'a lieu que dans l'eau pure
On réalise une solution saturée de chlorure d'argent. La constante d'équilibre associée à la réaction de dissolution du chlorure d'argent est K= 10^ -10.
AgCl(s)= Ag(+) + Cl(-)
----> aide :
K= [Ag+][Cl-]=s² avec s = solubilité (mol/L)- La solubilité du chlorure d'argent vaut 0,5 10^ -5 mol/L
- On ajoute une solution de chlorure de sodium à la solution précédente. L'équilibre est déplacé dans le sens indirect.
- En ajoutant un cristal AgCl on observe un précipité
- En ajoutant un cristal AgCl dans la solution on déplace l'équilibre dans le sens direct
transformation des ions dichromate en ion chrome III par action de l'acide oxalique. On relève l'avancement x de la réaction au cours du temps.
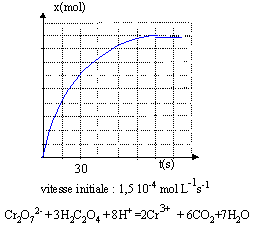
----> aide :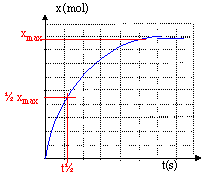
- Le temps de demi réaction vaut 60 s.
- le dioxyde de carbone se forme trois fois plus vite que les ions chrome III
- On considère que la réaction est terminée à t = 60 s
- La vitesse de la réaction augmente avec la température
Une solution aqueuse d'acide méthanoïque de concentration molaire c= 0,1 mol/L a un pH de 2,4. Le pKa du couple HCOOH/HCOO- est 3,8.
----> aide :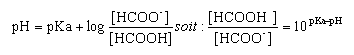
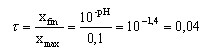
- l'expression de la constante d'acidité est :
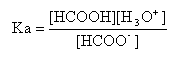
- Le rapport [HCOOH] / [HCOO-] vaut 0,04
- l'espèce chimique qui prédomine est HCOO-.
- Le taux d'avancement de la réaction de l'acide méthanoïque sur l'eau est 0,004
- l'expression de la constante d'acidité est :
On prépare 200 mL d'une solution S1 en dissolvant un comprimé de vitamine C dans de l'eau ( acide ascorbique). On dose V1 = 10 mL de cette solution avec une solution d'hydroxyde de sodium de concentration Cb= 0,01 mol/L. A l'équivalence on a ajouté Véq= 14 mL de réactif titrant.
Données : acide ascorbique C6H8O6, masse molaire 176 g/mol
pKa (acide ascorbique/ ion ascorbate : 4,1).
----> aide:
à l'équivalence 14*0,01 = 10 C soit C= 1,4 10^ -2 mol/L
Qté de matière d'acide ascorbique dans 0,2 L : 0,2*1,4 10^ -2 = 2,8 10^ -3 mol
soit en masse : 2,8 10^ -3*176 g- A l'équivalence le pH est égal à 7.
- La qté d'ion hydroxyde versé à l'équivalence est 1,4 10^ -4 mol
- La concentration C1 de la solution S1 est 7 10^ -4 mol/L
- La masse d'acide ascorbique dans le comprimé est de l'ordre de 0,5 g
Dans 20 mL d'éthanol pur on introduit 1 g de sodium. Une réaction exothermique, assez vive, se produit accompagnée d'un dégagement gazeux. L'équation bilan s'écrit :
C2H5OH + Na = C2H5O- +½ H2(g) + Na+.
données : Na : 23 ; C2H5OH 46 g/mol
masse volumique éthanol : 0,79 g/mL
----> aide :
Qté de matière Na : 1/23 = 0,044 mol
alocol : 20*0,79 = 15,8 g ; 15,8 / 46 = 0,34 mol- l'ion éthanolate est une base
- La réaction peut être considérée comme acido-basique
- Le sodium a été introduit en excès.
- La réaction peut être considérée comme totale
On donne le diagramme de distribution des espèces du couple acide fluorhydrique/ ion fluorure.
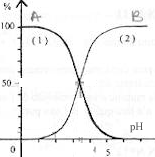
----> aide :
pKa du couple = pH à l'intersection des deux courbes- la courbe 2 correspond à l'acide fluorhydrique
- le pKa du couple vaut 3,2
- à pH=2 on compte 5% des molécules HF dissociées.
- lors de la dissolution de 0,1 mol d'acide fluorhydrique dans 1 L d'eau pur, la forme prédominante à l'équilibre chimique est l'ion fluorure.
On dispose de solutions acides de même concentration 0,01 mol/L. On mesure le pH de chaque solution.
acide pH chlorhydrique 2 hypochloreux 4,8 méthanoïque 2,9 sulfamique 2 ----> aide :
le taux d'avancement final est d'autant plus proche de 1( acide plus dissocié) que le pH est plus proche de -log C= 2.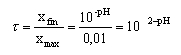
- la base conjuguée de l'acide sulfamique est une espèce qui ne réagit pas avec l'eau.
- l'acide hypochloreux réagit partiellement avec l'eau
- le taux d'avancement final de la réaction de l'acide sulfamique avec l'eau vaut 1.
- le taux d'avancement final de la réaction de l'acide méthanoïque avec l'eau est plus petit que le taux d'avancement final de la réaction de l'acide hypochloreux avec l'eau