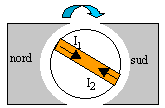|
d'après concours masso-kinésithérapie Rennes En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||
| .
. |
|||||||||||||
|
|||||||||||||
|
|
Entre la terre et la lune il existe un point où les forces de gravitation exercées par les deux astres sur un objet de masse m se compensent.
Données : Mterre = 5,98 1024 kg ; M lune = 7,4 1022 kg ; intensité de la force de gravitation exercée par la terre sur la lune : F= 2 1020 N ; constante de gravitation G= 6,67 10-11 SI. corrigé 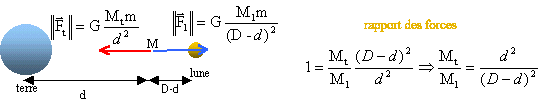
D :distance terre lune. avec Mterre / M lune = 5,98 1024 / 7,4 1022 = 80,81. prendre la racine carrée de l'expression : 80,81 = (d/D-d)² soit 9 = d/(D-d ) ; 9D-9d = d ; d= 0,9 D Comment calculer D, distance terre lune ? force exercée par la terre sur lea lune GMterreMlune / D²= 2 1020. D²= 6,67 10-11 * 5,98 1024*7,4 1022 / 2 1020 = 1,47 1017. D =3,84 108 m d'où d = 0,9*3,84 108 =3,45 108 m.
|
||||||||||||
|
Données : force de frottement f= (2,31ph0,6 d1,4 r 0,4 ) v1,4 ; viscosité h =0,03 Pa s ; r = 1000 kg/m3 ; d : diamètre de la sphère ; v : vitesse de la sphère ; g=9,81 m/s². corrigé A l'équilibre le poids de la sphère et la tension du ressort ont la même valeur mg = k(l-l0) masse (kg) = volume sphère (m3) * masse volumique sphère(kg/m3) ; m = 4/3pr3 m. 4/3pr3 mg = k(l-l0) soit m = 3 k(l-l0) / (4pr3 g ) m = 3*0,3(0,15-0,1) / (4*3,14*
(10-2)3*9,81)=366 kg/m3.
P=mg = V mg ; avec V : volume de la sphère (m3) P = r1 gVimmergé = r1 gV/3 P=P ; V mg = r1 gV/3 soit r1 = 3m = 366*3 = 1098 kg/m3.
poids : P=mg =10-3*9,8 = 9,8 10-3 N. poussée : P = r gVsphère = r g 4/3pr3 . 9,8 10-3 > r g 4/3pr3 soit r <3*9,8 10-3 / (g 4pr3 ) r <3 10-3 / ( 4*3,14*(310-3)3 ) r < 8846 kg/m3
.
son poids, vertical vers le bas P=mg la poussée d'Archimède, verticale vers le haut : P = r g4/3pr3 la force de frottement fluide, verticale vers le haut : f = (2,31ph0,6 d1,4 r 0,4 ) v1,4 ; Ecrire la seconde loi de Newton suivant un axe verticale orienté vers le bas : P-P-f = ma = mdv/dt mg - r g4/3pr3 - (2,31ph0,6 d1,4 r 0,4 ) v1,4 = m dv/dt dv/dt + (2,31ph0,6 d1,4 r 0,4 ) / m v1,4 = g - r g 4/(3m)pr3 . la vitesse limite étannt atteinte le terme dv/dt est nulle : (2,31ph0,6 d1,4 r 0,4 ) / m vl1,4 = g - r g 4/(3m)pr3 . vl1,4 = (mg - r g 4/3pr3) / (2,31ph0,6 d1,4r0,4 ). mg=9,8 10-3 N ; r g 4/3pr3 = 103*9,8*4/3*3,14*(3 10-3)3=1,1 10-3 N (2,31ph0,6 d1,4r0,4 ) = 2,31*3,14*0,030,6*(6 10-3)1,4*10000,4=7,253*0,122*7,75 10-4*15,84=1,08 10-2. vl1,4 =(9,8-1,1)10-3 / 1,08 10-2=0,8 d'où vl = 0,85 m/s.
Dv = v(t+Dt)-v(t) v(t+Dt) = v(t) + Dv (1) d'après l'équation différentielle : Dv / Dt + 1,08 10-2 / 10-3 v1,4 = 9,8-1,1 Dv / Dt + 10,8 v1,4 = 8,7 Dv = (8,7- 10,8 v1,4 )Dt (2) à t=0 la vitesse initiale est nulle et Dv (0)=8,7*0,005 = 0,0435 m/s repport dans (1) : v(0,005) = 0 + 0,0435
= 0,0435 m/s.
repport dans (1) : v(0,01) = 0,0435
+0,0428= 0,0863 m/s.
repport dans (1) : v(0,015) = 0,0863 +0,04175= 0,128 m/s.
repport dans (1) : v(0,02) = 0,128
+0,0404= 0,168 m/s.
repport dans (1) : v(0,025) = 0,168 +0,039= 0,207 m/s.
|
|||||||||||||
corrigé 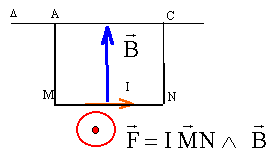
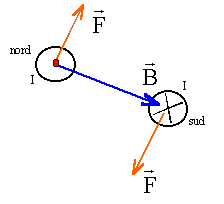
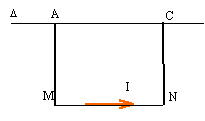
F= I*MN*B d'où B= F/(MN*I)= 0,04/(5*0,1) = 0,08 T les vecteurs B et
AM et CN sont colinéaires : donc les branches AM et CN ne sont
soumisent à aucune force électromagnétique.
Le moteur convertit de l'énergie électrique en énergie mécanique.
le courant va dans le sens I1. |
|||||||||||||
|
On prépare 100 mL de solution de dichromate de potassium en
dissolvant 0,470 g de solide dans une fiole jaugée. Avec cette solution
on dose des ions Fe2+ contenus dans une solution S.La prise
d'essai est 20 mL. Le volume versé à l'équivalence est 15 mL Quelle est
la concentration en ion fer II de la solution S ? couples redox : Cr2O72- / Cr3+ ; Fe3+ / Fe2+. corrigé Cr2O72- + 6e- + 14H+ = 2Cr3+ + 7H2O 6Fe2+ = 6Fe3+ + 6e- Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 7H2O + 6Fe3+ Qté de matière dichromate de potassium : 0,47 / 294,19 = 1,6 10-3 mol. [Cr2O72-]=1,6 10-3 / 0,1 =0,016 mol/L
[Fe2+]= 1,44 10-3 /20 10-3 = 7,2 10-2 mol/L.
|
|||||||||||||
|
On réalise le mélange de 200 mL de solution de chlorure de potassium à 5 10-3 mol/L et de 800 mL de solution de chlorure de plomb à 1,25 10-3 mol/L. Quelle est la conductivité de la solution obtenue ? lK+ = 74 10-4 S m2 mol-1 ; lCl- = 76 10-4 S m2 mol-1 ; lPb2+ = 140 10-4 S m2 mol-1 . corrigé conductivité s = lK+ [K+] + lCl-[Cl-] + lPb2+ [Pb2+] volume du mélange : 1 L = 10-3 m3 ; ; [K+] = 5 10-3 *0,2 / 10-3 = 1 mol/m3. [Pb2+] = 1,25 10-3 *0,8 / 10-3 = 1 mol/m3. les ions chlorure sont issus des deux solutions: PbCl2 solide = Pb2+ + 2Cl- ; [Cl-] = ( 5 10-3*0,2 + 2 *0,8*1,25) / 10-3 = 3 mol/m3. s = 74 10-4 * 1 + 76 10-4 * 3 + 140 10-4 *1 = 442 10-4 = 4,42 10-2 Sm-1.
|
|||||||||||||
|
On se propose de vérifier le degré de pureté du bicarbonate de soude NaHCO3. Etape 1 : réaction avec l'acide chlorhydrique : on fait réagir 1 g de bicarbonate de soude avec 25 mL d'acide chlorhydrique à 1 mol/L. Soit S1 la solution obtenue après réaction. Cette solution est chauffée pendant quelques minutes. Etape 2 : titrage de l'excès d'acide chlorhydrique par une solution de soude. : on verse la solution S1 dans une fiole jaugée et on complète à 200 mL avec de l'eau distillée. Soit S2 cette solution. On dose 20 mL de S2 avec une solution de soude de concentration cb=0,1 mol/L en utilisant un indicateur coloré.
masse atomique molaire (g/mol) Na=23 ; H=1 ;O=16 ; C=12. couples CO2, H2O / HCO3- pKa = 6,4 ; HCO3- / CO32- pKa = 10,3 corrigé HCO3- + H3O+ = CO2 + 2H2O CO2 + 2H2O = HCO3- + H3O+ ; Ka= [HCO3- ][H3O+] / [CO2] Kéqui= [CO2] / ([HCO3- ][H3O+]= 1/Ka = 106,4 = 2,5 106. Le chauffage
élimine le CO2 dissout : celui ci est un acide qui pourrait
réagir avec la soude dans l'étape 2 et fausser le dosage.
à l'équivalence acide-base la quantité de matière d'ion oxonium est éagle à la quantité de matière d'ion hydroxyde ajouté. cava=
cbvéqui soit ca = 13,6 10-3
*0,1 / 20 10-3 =6,8 10-2 mol/L
0,068*0,2 = 0,0136 mol Qté de matière d'ion oxonium apporté par l'acide (étape 1) : 0,025*1 = 0,025 mol Qté de matière d'ion oxonium ayant réagi (étape 1) : 0,025-0,0136 = 0,0114 mol Qté de matière hydrogénocarbonate de sodium :0,0114 mol masse molaire NaHCO3: 23 + 1+12+3*16 = 84 g/mol masse hydrogénocarbonate pur dans 1 g d'échantillon : 84*0,0114 = 0,958 g degré de pureté : 0,958 ou 95,8 %.
|
|||||||||||||
|
La combustion complète dans le dioxygène d'une masse m0
= 1g d'un ester dont la chaîne carbonée ne comporte pas de liaison
multiple, ni cycle, a conduit à la formation d'une masse m=2,157 g de CO2. - Ecrire les formules possibles de l'ester sachant que l'hydrolyse donne de l'acide méthanoïque. corrigé formule brute de l'ester : CnH2nO2. combustion : CnH2nO2 + (1,5 n -1) O2 = n CO2 + n H2O. Qté de matière CO2 : 2,157 / 44 =0,049 mol donc d'après l'équation de réaction : 0,049 / m m ol d'ester Qté de matière ester ( masse molaire M = 12n + 2n +32 = 14 n+32) : 1/M mol par suite : 1/M=0,049/n soit n/0,049 = M ; 20,4 n = 14 n+32 soit n = 5 H-COO - CH2-CH2-CH2-CH3 méthanoate de butyle H-COO - CH2-CH (CH3)2 méthanoate de 2-méthylpropyle H-COO - CH(CH3)-CH2 -CH3 méthanoate de 1-méthylpropyle H-COO - C(CH3)3 méthanoate de 2,2-diméthyléthyle
|
|||||||||||||
|
|