|
Oscillateur mécanique -satellite- épaisseur d'un cheveu - dosage conductimétrique - synthèse du benzoate de méthyle En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
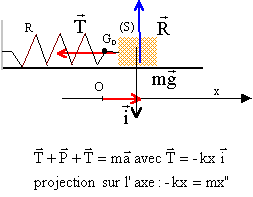
A aspect statique : On désire déterminer la constante de raideur k d'un ressort (R) à spires non jointives. Accroché verticalement à une potence le ressort possède une longueur l0=6,3 cm. On suspend à l'extrémité libre un petit solide de masse m=50 g, le ressort mesure alors l1=9,8 cm.
B aspect dynamique : On réalise maintenant un oscillateur dynamique constitué : - D'un solide (S) de centre d'inertie G et de masse m inconnue pouvant glisser sur un axe horizontal. - Du ressort (R) de constante de raideur k et de masse négligeable par rapport à m. 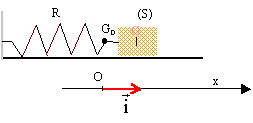 Lorsque le solide (S) est à l'équilibre, le point G se situe en G0, à la verticale du point O, choisi comme origine. On écarte le solide de sa position initiale puis on le lâche. Un oscilloscope à mémoire permet d'enregistrer les variations de l'abscisses x du point G en fonction du temps. A une date quelconque on déclenche l'enregistrement. On obtient la figure ci-dessous. Les frottements sont négligeables sur la durée de l'étude. 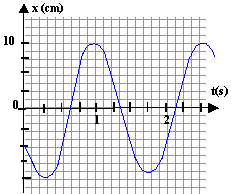
C aspect énergétique :
corrigé 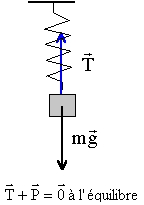
k(l1-l0)= mg soit
k = mg / (l1-l0) = 0,05*9,8/((9,8-6,3) 10-2)
= 14 N/m.
soit x" + k/m x = 0 on pose w0²= k/m. d'après le graphe T0 = 1,5 s. T0 = 2p/w0 soit w0 = 2p/ T0 = 6,28 / 1,5 = 4,187 rad/s m= k/w²0 = 14/4,187²= 0,8 kg. à t=0, x(0) = -5 cm ; l'amplitude vaut Xm=10 cm x0) = -5 = 10 cos( 4,187 *0 + j) cos j = -5/10 = -0,5 soit j = 2,094 rad ou j = -2,094 rad. vitesse : dérivée de x(t) par rapport au temps : v(t) = -Xm w0 sin(w0t+ j) la vitesse correspond au coefficient directeur de la tangente à la courbe x(t) à la date considérée : or à t=0 la vitesse V0 est négative. V0= -0,1 *4,187 sin j = -0,4187 sinj d'où le choix de j = 2,094 rad. V0= - 0,4187*0,866 = -0,363 m/s.
On choisit ce plan comme origine de l'énergie potentielle de pesanteur : alors Epp=0. énergie cinétique de (S) : Ec= ½mv² = ½ X²m m w²0 sin²(w0t+ j) = ½X²m k² sin²(w0t+ j) énergie potentielle élastique : Epk= ½kx²= ½kX²m cos²(w0t+j) énergie mécanique : EM= Epk+ Ec= ½kX²m ( sin²(w0t+ j)+cos²(w0t+j))= ½kX²m EM= 0,5*14*0,1²= 0,07 J.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Une planète P de masse MP de notre système solaire possède un satellite naturel S de masse mS dont le mouvement dans un repère " planétocentrique " peut être considéré comme circulaire et uniforme. Rayon r = 1,2 millions de km ; période T= 16 jours.
Données : G= 6,67 10-11 S.I ; Mterre= 6 1024 kg
corrigé La planète sert de référentiel. L'origine du repère est le centre de la planète. Les trois axes pointent vers des étoiles lointaines qui paraissent fixes. T²/r3=4p²/(GMP) : 3ème loi de Kepler. T = 16*24*3600 = 1,382 106 s ; T² = 1,911 1012 s². r= 1,2 109 m ; r3 = 1,816 1027 m3. T²/r3= 1,911 1012 / 1,816 1027 =1,052 10-15. MP= 4*3,14²/(6,67 10-11 *1,052 10-15)=5,62 1026 kg. MP/Mterre = 5,62 1026 / 6 1024 = 93,6 donc saturne.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
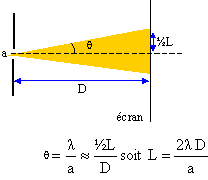
On dispose d'un laser Hélium-Nèon de longueur d'onde l= 632,8 nm, d'un écran et de fentes de différentes épaisseurs. On envoie le faisceau de lumière sur l'écran. On intercale ensuite, sur le trajet du rayon, une fente verticale de largeur a située à la distance D de l'écran. On observe sur l'écran une tache centrale lumineuse de largeur L nettement supérieure à a, ainsi qu'une série de taches plus petites de part et d'autre de la tache centrale.
corrigé 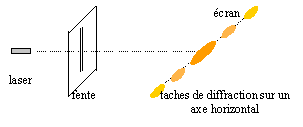
le phénomène de diffraction prouve que la lumière est une onde ( électromagnétique) la largueur a de la fente doit être de l'ordre de grandeur de la longueur d'onde l.
L1a1 = 5 10-2 * 4 10-5 = 2 10-6 m². L2a2 = 2 10-2 * 10-4 = 2 10-6 m². L1a1 = L2a2 : la relation précédente est donc vérifiée. diamètre F du cheveu : F *2,5 10-2 = 2 10-6 soit F = 2 10-6 / 2,5 10-2 = 8 10-5 m = 80 mm.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
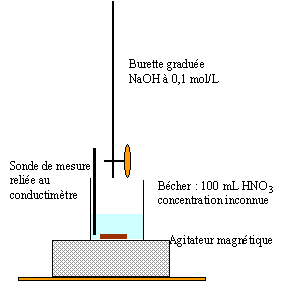
On souhaite déterminer la concentration c0 d'une solution S0 d'acide nitrique (H3O+ + NO3-)
corrigé fiole jaugée 100 mL et piette graduée 10 mL prélever 10 mL de la solution mère S0 à l'aide de la pipette (+ pipeteur) placer dans la fiole jaugée et compléter avec de l'eau distillée jusqu'au trait de jauge.
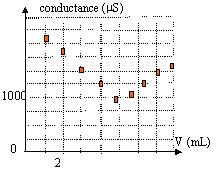
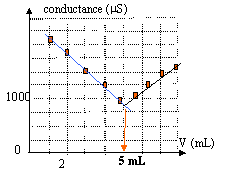
H3O+ + HO- = 2H2O avant l'équivalence : les ions oxonium sont en escès dans le bécher. Tout ce passe comme si on remplaçait les ions oxonium par les ions sodium de conductivité moindre; donc la conductivité et la conductance vont diminuer. après l'équivalence : on ajoute des ions sodium et hydroxyde : donc la conductivité et la conductance vont croître. le volume à l'équivalence est obtenu à l'intersection des deux droites.
En diluant 10 fois S0, il ne faut ajouter que 5 mL de soude dans 100 mL de S1 pour atteindre l'équivalence. on peut considérer que le volume dans le bécher ne varie pratiquement pas. d'autre part pour des concentrations faibles, conductance et concentration sont proportionnelles. à l'équivalence : 5*0,1 = 100 C1 soit C1 = 5 10-3 mol/L C0 = 5 10-2 mol/L.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
A - la molécule de benzoate de méthyle C6H5-COO CH3.
B - synthèse du benzoate de méthyle : mode opératoire. Dans un ballon surmonté d'un réfrigérant on introduit un excès d'alcool, de l'acide carboxylique ainsi que de l'acide sulfurique. On chauffe le ballon du dispositif pendant un certain temps.
C- extraction du benzoate de m éthyle.
D- Etude de l'équilibre chimique Dans le mélange réactionnel il a été introduit 1 mol d'acide carboxylique et 1,44 mol d'alcool. Quand le mélange réactionnel n'évolue plus, grâce à une extraction méticuleuse on récupère ( sans perte de produit chimique) 108,8 g de benzoate de méthyle.
corrigé C6H5-COO H + CH3OH = C6H5-COO CH3 + H2O acide benzoïque + méthanol ( alcool
primaire)
réaction d'esterification, lente , athermique, limitée par l'hydrolyse de l'ester. En travaillant à température modérée, la réaction est plus rapide. l'acide sulfurique est un catalyseur.
la phase inférieure la plus dense contient l'eau, l'acide sulfurique, le méthanol, le benzoate de sodium, la soude en excès la phase supérieure, la moins dense contient le benzoate de méthyle dans l'ether. On peur réaliser une séparation dans une ampoule à décanter. acide sulfurique : H3O+ + HO- = 2H2O acide benzoïque :C6H5-COO H+ HO- = C6H5-COO - + H2O la solution aqueuse d'hydroxyde de sodium fait passer en milieu neutre ou basique et transforme l'acide benzoïque restant ( soluble dans l'ether) en ion benzoate, insoluble dans l'éther, mais soluble dans l'eau : ce protocole permet d'isoler le benzoate de méthyle dans l'ether. réaction parasite : saponification de l'ester, lente C6H5-COO CH3 + HO- = C6H5-COO - + CH3OH on ne peut pas attendre une nuit avant
de réaliser l'extraction, car une partie de l'ester sera saponifié.
xéq = 108,8 / 136 =0,8 mol K=x²éq /((1,44-xéq)(1-xéq)) = 0,8²/(0,64*0,2) = 5. K= [ester]éq[eau]éq/([acide]éq[alcool]éq. pour un alcool primaire la constante d'équilibre vaut 4 ; pour un alcool secondaire la constante d'équilibre vaut 2,25 ; dans ce dernier cas , la quantité d'ester formé à l'équilibre est inférieure à celle obtenue avec un alcool primaire. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|