Dans une enceinte fermée, thermostatée on introduit 65 mg de zinc en poudre dans 100 mL de solution aqueuse d'acide chlorhydrique à la concentration molaire c=1 mol/L
L'équation de la réaction modélisant la transformation est :
Zn(s) + 2H+ = H2(g) + Zn2+
La transformation chimique est totale. Zn = 65 g/mol
----> aide :
Qté matière initiale : Zn : 0,065/65 = 1 mmol
acide : 100*1 = 100 mmolZn(s) +2 H+ = H2(g) + Zn2+ initial 1 mmol 100 mmol 0 0 en cours 1-x 100-2x x x final 0 mmol 100-2=98 mmol Xmax= 1 mmol Xmax=1 mmol - Le zinc est le réactif limitant
- l'avancement maximal vaut 0,05 mol
- pour 3 min l'avancement vaut 0,5 mmol : 3 min est le temps de demi-réaction
- Le volume molaire vaut 24 L/mol. Le volume de dihydrogène final est 2,4 mL
Pour étudier rapidement la décomposition des ions hypochlorite ClO- contenus dans l'eau de javel, on travaille en présence d'ion cobalt II Co2+.
La réaction est modélisée par l'équation : 2 ClO- = 2Cl- + O2(g)
On mesure sous une pression constante P=101 kPa le volume de dioxygène produit à partir de l'instant ou l'on introduit les ions cobalt II.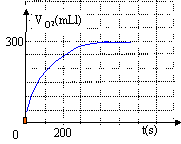
volume molaire : 24 L/mol ; R= 8,3 J/K/mol ; 24/8,3 = 2,89
----> aide :
avancement maximal = volume maximal O2 / volume molaire = 300 / 24 =12,5 mmol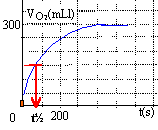
loi des gaz parfaits : PV= nRT ;( V= 24 10^ -3 m3 et n=1 mol)
T= PV/(nR) = 1,01 10^ 5 * 24 10^ -3 /( 1 *8,31)=101*2,89 = 292 K- L'avancement maximal est 12,5 mmol
- t½= 150 s.
- L'étude de la réaction s'est effectuée à une température voisine de 19°C.
- Les ions Co2+ ont été consommés au cours de la réaction.
On étudie la cinétique de la réaction des ions peroxodisulfate S2O8(2-) avec les ions iodures I- d'équation : S2O8(2-) + 2 I- = I2 + 2 SO4 (2-)
Les ions peroxodisulfate sont en excès par rapport aux ions iodure.
----> aide :S2O8(2-) + 2I - = I2 + 2SO4(2-) initial excès n 0 0 en cours n-2x x 2x fin n-2*0,015=0 0,015
à t=1000 s, [I-]=0,03-2*0,012 = 0,006 mol- La conductimétrie peut être envisagées comme méthode de suivi de l'évolution de la réaction
- la pH-métrie peut être envisagée comme méthode de suivi de l'évolution de la réaction
- On suit l'évolution par spectrophotométrie en mesurant l'absorbance A àla longueur d'onde de 575 nm du diiode formé.
La courbe d'étalonnage du spectrophotomètre est la suivante :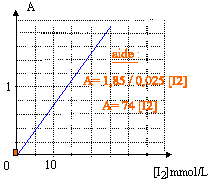
La courbe suivante donne la variation au cours du temps de l'absorbance A du milieu réactionnel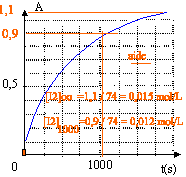
à t=0 la concentration en ion iodure était 0,015 mol/L - à t = 1000 s la concentration en ion iodure est 0,003 mol/L
On considère à 25 °C une solution aqueuse S1 d'acide méthanoïque HCOOH de concentration molaire apportée C1=0,05 mol/L et une solution S2 d'acide benzoïque C6H5-COOH ayant le même pH égal à 2,5.
masse volumique acide méthanoïque pur : 1,18 mg/L
pKa( HCOOH / HCOO-) = 3,8 ; pKa(C6H5COOH / C6H5COO-)=4,2- La solution aqueuse d'acide formique est moins dissociée en ions que celle de l'acide benzoïque.
----> aide : à pH égal, l'avancement final, la quantité de matière d'ion oxonium finales sont identiques. - La préparation de 500 mL de la solution aqueuse S1 nécessite moins d'un mL d'acide pur.
----> aide :
masse molaire acide méthanoIque HCOOH :46 g/mol
masse de 1L d'acide pur : 1180g
Qté matière acide pur dans 1 L : 1180/46 = 25,6 mol
facteur de dilution = rapport des concentrations = 25,6 / 0,05=513
volume solution mère à prélever = volume fiole jaugée / 513 - Dans la solution S2 l'égalité suivante est vérifiée : [C6H5COOH]éq = 50 [C6H5COO-]éq.
----> aide :
pH=pKa + log ([C6H5COO-]/[C6H5COOH])
log ([C6H5COO-]/[C6H5COOH]) = pH-pKa = 2,5-4,2 = -1,7
([C6H5COO-]/[C6H5COOH] = 10 ^ -1,7 = 0,02. - Si pour préparer la solution aqueuse S2, on effectue la dilution à 15 °C, l'état d'équilibre est plus long à obtenir.
----> aide :
la température est un facteur cinétique.
mais les réactions acides bases sont rapides.
- La solution aqueuse d'acide formique est moins dissociée en ions que celle de l'acide benzoïque.
On dissout 0,1 mol d'ammoniac NH3 gazeux dans de l'eau pure, de façon à obtenir 200 mL de solution.
- La réaction de l'ammoniac sur l'eau est : NH3(g) + H2O = NH4(+) + HO(-)
- L'ammoniac NH3 est un acide
----> aide
NH3 base conjuguée de l'ion ammonium NH4(+) - Le pH-mètre mesure la conductance de la solution
- Le pH mesuré est égal à 11,4. L'avancement final est Xf= 8 10^ -13 mol.
----> aide :
Xf = Qté de matière HO-.
[H3O+]= 10^ -11,4
[HO-]= 10^ -14 / 10^ -11,4 =10^ -2,6 = 0,0025 mol/L
Xf = 0,0025*0,2 = 5 10^ -4 mol.
Le rouge de méthyle est un indicateur coloré dont le pKa est 5,2. Sa teinte est rouge en milieu très acide et jaune en milieu basique. On a reprèsenté ci-dessous la formule topologique d'une des espèces prèsentes dans une solution de cet indicateur coloré.
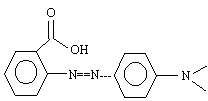
- Le rouge de méthyle possède une fonction acide carboxylique
- La molécule représentée donne un couleur rouge à la solution.
----> aide :
à pH <pKa-1 (soit 4,2) la forme acide du couple acide base prédomine ; cette forme acide est rouge. - en milieu neutre, l'indicateur coloré teinte la solution en jaune à 25°C.
----> aide :
à pH>pKa+1 ( soit 6,2) la forme base, de couleur jaune, du couple acide base prédomine. - Lorsque l'indicateur est dans un milieu dont le pH est 7,2, la proportion de l'espèce acide est d'environ 1%.
----> aide :
pH=pKa+ log([base conjuguée] / [acide])
log([base conjuguée] / [acide]) = 7,2-5,2 = 2
[base conjuguée] / [acide] = 100
L'acide benzoïque de formule C6H5-COOH est un solide blanc, peu soluble dans l'eau. On dispose d'une solution d'acide benzoïque de concentration en soluté apporté C=0,01 mol/L. Le pH mesuré est 3,1.
- La formule topologique de l'acide benzoïque est :
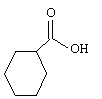
- La base conjuguée de l'acide benzoïque a pour formule semi-développée C6H4-COOH-
- La réaction de l'acide benzoïque avec l'eau n'est pas totale
- Le taux d'avancement de la réaction est inférieur à 10 %.
----> aide :
taux d'avancement = 10^ -pH / C = 10^ -3,1 / 0,01 = 10^ -1,1 = 0,08.
- La formule topologique de l'acide benzoïque est :
Dans une fiole jaugée de 100 mL on réalise le mélange de :
10 mL de solution aqueuse d'acide chloroacétique CH2Cl-COOH
10 mL de solution aqueuse de chloroacétate de sodium CH2ClCOO- et Na+
20 mL de solution aqueuse de chlorure d'ammonium NH4(+) et Cl-
20 mL de solution aqueuse d'ammoniac NH3.
Toutes ces solutionsont la même concentration molaire apportée C= 0,01 mol/L.
On complète avec de l'eau distillée jusqu'au trait de jauge.
L'équation modélisant la transformation chimique envisagée est :
CH2Cl-COOH + NH3 = CH2Cl-COO- + NH4(+)
pKa ( acide chloroacétique / ion chloroacétate) = 2,9 ; pka (ion ammonium / ammoniac) = 9,2- dans le mélange [CH2Cl-COOH] initiale = 0,001 mol/L
----> aide :
volume total du mélange 0,1 L
concentration initiale CH2Cl-COOH dans ce mélange : 10*0,01/100 = 0,001 mol/L
le facteur de dilution est : 10. - La constante d'équilibre correspondant à la réaction vaut 6,3.
----> aide :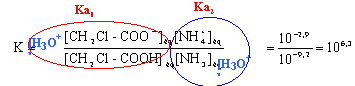
- La transformation va évoluer dans le sens de la formation de CH2Cl-COO-
----> aide :
si Qr i <K alors évolution dans le sens direct, de gauche à droite.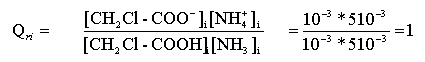
- Le quotient de réaction augmente au cours de l'évolution spontanée du système.
- dans le mélange [CH2Cl-COOH] initiale = 0,001 mol/L
La caféine constitue la forme basique du couple acide base noté BH+ / B.
Dans l'eau la caféine se comporte suivant le modèle d'équation chimique:
B+H2O = BH+ et HO-.
A 25°C sous 1 bar on mesure la conductivité de 500 mL de solution contenant initialement 0,01 mol de cafèine. On trouve 0,04 S/m.
Conductivité molaire ionique (Sm²/mol) HO- : 0,02 ; la conductivité de BH+ est négligeable.
----> aide :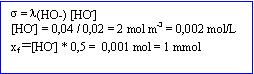
- L'avancement final est Xf = 1 mmol.
- La concentration molaire finale en caféine est 4,5 mmol/L
- Le pH de la solution vaut 11,3
----> aide :
[H3O+]= 10^ -14 / 0,002 = 5 10^ -12 mol/L
pH = -log( 5 10^ -12) - l'état d'équilibre est statique
----> aide :
durant la même durée il se forme autant de mol BH+ dans le sens direct qu'il n'en disparaît dans le sens indirect.
On verse un volume V1 = 10 mL d'une solution aqueuse de chlorure de calcium (Ca2+ et 2Cl-) de concentration apportée C1= 0,1 mol/L dans un volume V2 = 10 mL de solution aqueuse de carbonate de sodium( 2Na+ et CO3(2-)) de concentration apportée C2= 0,1 mol/L. On observe alors la formation d'un précipité blanc de carbonate de calcium, selon la réaction :
Ca2+ et CO3(2-)= Ca CO3(s)
La constante de cette réaction est K= 10^8.- Le quotient initial de la réaction est inférieur à la constante d'équilibre K.
----> aide :
[Ca2+] initiale dans le mélange = 10*0.1/20=0,05 mol/L
[CO3(2-)] initiale dans le mélange = 0,1*10/20 = 0,05 mol/L
Q r i = 1/([Ca2+]i[CO3(2-)]i)=1/(0,05*0,05)= 400 - Le quotient initial de la réaction Q r i = 100
- A l'équilibre la concentration en ion molaire en ion carbonate est 10^ -4 mol/L
----> aide :
K = 10^ 8 = 1/([Ca2+]éq[CO3(2-)]éq)
[Ca2+]éq = [CO3(2-)]éq - Après passage à l'étuve du précipité on obtient une masse de 100 mg
----> aide :
masse molaire CaCO3 : 40+12+3*16 = 100 g/mol
Qté de matière CaCO3 : 0,1*10 = 1 mmol
- Le quotient initial de la réaction est inférieur à la constante d'équilibre K.
On forme une pile argent cuivre en associant :
Une demi pile A, constituée d'une électrode d'argent Ag de masse m1=10,8 g plongeant dans 1 L d'une solution aqueuse de nitrate d'argent ( Ag+ et NO3(-)) à 0,1 mol/L.
Une demi pile B constituée d'une électrode de cuivre Cu de masse m2= 12,7 g plongeant dans 1 L d'une solution de sulfate de cuivre ( Cu2+ et SO4(2-)) à 0,1 mol/L
La réaction 2 Ag+ + Cu's) = Cu2+ + 2Ag(s) a pour constante d'équilibre K= 2,15 10^ 15 à 25°C.
Ag =108 et Cu = 63,5 g/mol- Dans l'état initial, le quotient de cette réaction est Q r i = 10.
----> aide :
Qr i = [Cu2+]i / [Ag+]i² = 0,1 / 0,1²= 10 - L'électrode de cuivre est le pôle positif
----> aide : le cuivre s'oxyde et libére des électrons. Le cuivre constitue l'anode négative. - La réaction qui se produit dans la demi pile A est Ag+ + 1 electron = Ag(s)
----> aide :
les ions argent se réduisent à la cathode positive. - La capacité de la pile est Q= 19300 C.
----> aide :avancement 2Ag+ + Cu(s) t=0 0 0,1 12,7 / 63,5 = 0,2 mol en cours x 0,1-2x 0,2-x fin 0,05 0 0,15
donc 0,1 mol d'électrons mis en jeu :
96500*0,1 = 9650 C
- Dans l'état initial, le quotient de cette réaction est Q r i = 10.
On réalise la pile suivante : Cr(s) / Cr3+ // Ag+ / Ag(s)
Compartiment 1 : 100 mL de solution de nitrate de chrome III de concentration molaire apportée initiale en ion chrome III 0,1 mol/L
Compartiment 2 : 100 mL de solution de nitrate d'argent de concentration molaire apportée initiale en ion argent : 0,1 mol/L.
Un ampéremètre placé dans le circuit extérieur affiche une valeur positive de l'intensité lorsque sa borne COM est reliée au chrome.
Au cours du fonctionnement la masse d'une électrode diminue de 104 mg.
Cr : 52 ; Ag : 108 g/mol- L'électrode d'argent voit sa masse diminuer.
----> aide :
d'après le branchement de l'ampèremètre, le chrome constitue la borne négative de la pile
Le chrome s'oxyde Cr = Cr3+ et 3 e-
les ions argent se réduisent :
3 Ag+ et 3e- = 3Ag - L'autre électrode subit une variation de masse de : 648 mg.
----> aide :Cr(s) +3Ag+ =Cr3+ +3Ag(s) initial n mmol 10 mmol 0 0 en cours n-x 10-3x x 3x fin 104/52=2 mmol 4 mmol 2 mmol 6 mmol 6 mmol*108 = 648 mmol - La concentration molaire finale en ion chrome III est 0,12 mol/L
----> aide :
(10+2) / 100 = 0,12 - La pile a atteint un état d'équilibre
- L'électrode d'argent voit sa masse diminuer.
Une unité de fabrication de dihydrogène par électrolyse de l'eau fabrique 450 m3 à l'heure de ce gaz ( volume rapporté dans les conditions normales de température et de pression). L'électrolyte utilisé est une solution d'hydroxyde de potassium ( K+ et HO-).
0 l'électrode où se produit le dihydrogène, l'équation bilan de la réaction peut s'écrire :
2H2O (l)+ 2e- = H2(g) + 2HO-.- Le dihydrogène apparaît à la cathode de l'électrolyseur.
- La quantité de matière de dihydrogène produite est environ 20 mol/heure.
----> aide :
450 000 L diviser par le volume molaire 22,4 L/mol - L'intensité du courant dans l'électrolyseur est 1,1 10^ 3 kA
----> aide :
20 000 mol H2 donc 40 000 mol d'électrons
Qté d'électricité : 40 000*96 500 C
Q= I t
donc diviser par la durée en seconde (3600 s) - Lors d'une électrolyse le système chimique évolue en se rapprochant de l'état d'équilibre.
----> aide :
électrolyse = transformation forcée qui s'arrête dès que l'on coupe le courant.
On réalise un montage à reflux en plaçant dans un ballon 12,2 g d'acide benzoïque solide C6H5-COOH, 40 mL de méthanol CH3OH, quelques gouttes d'acide sulfurique H2SO4 et de la pierre ponce. On obtient du benzoate de méthyle liquide à odeur forte et aromatique présent dans l'oeillet.
composés masse molaire (g/mol) masse volumique (g/mL) à 20°C acide benzoïque 122 1,3 méthanol 32 0,8 benzoate de méthyle 136 1,1 - L'acide sulfurique permet d'obtenir un taux d'avancement égal à 1.
- On utilise le montage suivant :
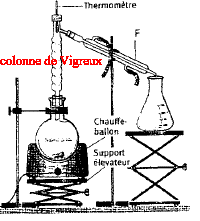
- Le méthanol est le réactif limitant.
----> aide :
acide benzoïque : 12,2 / 122 = 0,1 mol
méthanol : 40*0,8 = 32 g
32 / 32 = 1 mol - Après refroidissement on verse le contenu du ballon dans une ampoule à décanter, on obtient deux phases. Après traitement de la phase contenant l'ester on récupère une masse m= 10,2 g de benzoate de méthyle. La réaction de synthèse est limitée.
----> aide :
Qté théorique d'ester ( si réaction totale) : 0,1 mol soit 13,6 g
Le benzoate de benzyle C6H5-COOCH2-C6H5 est un antiseptique.
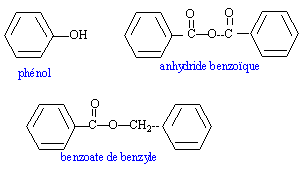
On hydrolyse le benzoate de benzyle extrait d'un échantillon de sirop pour la toux avec 50 mL d'une solution aqueuse d'hydroxyde de sodium de concentration molaire apportée C= 0,1 mol/L. On réalise ensuite le dosage de l'excès d'ion hydroxyde par l'acide chlorhydrique de concentration Ca= 0,1 mol/L. Le volume équivalent est v=18 mL.- Il s'agit d'un ester du phénol
- Il peut être synthétisé à partir de l'anhydride benzoïque
- Le dosage peut être effectué par conductimétrie
- Le sirop contient 3,2 mmol de benzoate de benzyle
----> aide :
Qté de matière d'ion hydroxyde :
initiale : 50*0,1 = 5 mmol
en excès 18*0,1 = 1,8 mmol
réagit avec l'ester : 5-1,8 = 3,2 mmol
La butyrine est un corps gras, obtenu par action deu glycérol CH2OH-CHOH-CH2OH sur l'acide butyrique CH3-CH2-CH2-COOH en présence d'acide sulfurique concentré.
----> aide :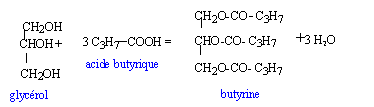
On saponifie la butyrine par un excès de potasse concentrée (K+ et HO-) . Le mélange réactionnel est chauffé à reflux puis versé dans l'eau salée.- La masse molaire de la butyrine est M=302 g/mol
- l'acide sulfurique n'influe pas sur la vitesse de la réaction
- Pour saponifié 6,04 kg de butyrine il faut 20 mol d'ion hydroxyde.
----> aide :
butyrine + 3 potasse = 3 butyrate de potassium + glycérol
6040 / 302 = 20 mol butyrine
donc d'après l'équation ci-dessus : 3*20 = 60 mol potasse - Dans une molécule de savon, la chaine carbonée constitue la partie hydrophile