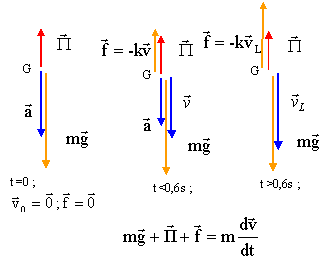|
datation d'une roche - chute d'une bille d'après concours service de santé des armées En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||
| .
. |
||||||||||||||||||||
|
||||||||||||||||||||
|
|
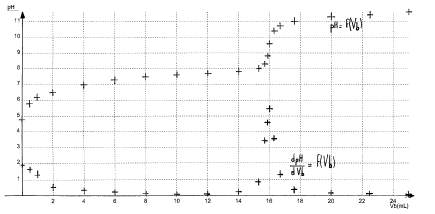
solution d’acide hypochloreux. ( 6,25 points ) On dispose d’un flacon d’une solution aqueuse S d’acide hypochloreux HClO dont l’étiquette indique une concentration molaire apportée CA que l’on cherche. Données : teintes et zone de virage du rouge de crésol : jaune 7,2 – 8,8 rouge ; pKAdu couple HClO(aq) / ClO-(aq) : pKa = 7,25 ; Le pH de la solution S est : pH = 4,8.
corrigé 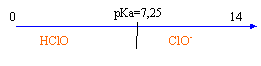
à pH=pKa la forme acide HClO et la forme base conjuguée ClO- sont en quantité égale. HClO+HO- = ClO- + H2O à l'équivalence du dosage acide base la courbe dérivée présente un maximum ; vBE= 16 mL à l'équivalence
les réactifs mis en présence sont en quantité stoechiomètrique : avant
l'équivalence l'un des réactifs est en excès ; après l'équivalence
l'autre réactif est en excès.
0,02 CA=xéq = 1,6 10-4 d'où CA= 8 10-3 mol/L. La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent ( voisin de 9 dans ce cas) le rouge de crésol ne convient pas, la phénolphtaléine conviendrait mieux.
|
|||||||||||||||||||
|
fonctionnement d’une pile. ( 9,5 points ) Données : un faraday est la valeur absolue de la charge électrique d’une mole d’électrons. 1 Faraday = 1F = 96500 C.mol -1. On réalise une pile composée des deux demi-piles suivantes : - une lame de cuivre Cu plongeant dans 100 mL de solution aqueuse de sulfate de cuivre (Cu2+ (aq) + SO42-(aq)) de concentration molaire apportée C1= 0,50 mol.L-1 ; - une lame d’argent Ag plongeant dans 100 mL de solution aqueuse de nitrate d’argent (Ag+(aq) + NO3-(aq)) de concentration molaire apportée C2= 0,10 mol.L-1 ; - les deux demi-piles sont reliées par un pont salin de nitrate de potassium. La pile est branchée aux bornes d’un conducteur ohmique. Un ampèremètre indique que le courant circule de l’électrode d’argent vers l’électrode de cuivre.
corrigé 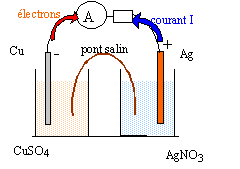
- Cu / Cu2+ //Ag+/Ag + Cu = Cu2+ + 2e- oxydation du cuivre 2Ag+ + 2e- =2Ag réduction de Ag+. 2Ag+ +Cu=Cu2+ +2Ag quotient de réaction initial Qr,i =[Cu2+]/[Ag+]2=0,5 / 0,12 = 50. Qr,i < K donc évolution spontanée dans le sens direct. [Cu2+] augmente et [Ag+] diminue. à partir du pont salin, migration des ions nitrate dans le compartiment contenant le sulfate de cuivre et migration des ions potassium dans le compartiment contenant le nitrate d'argent afin que chaque solution reste électriquement neutre. Qté de matière d'ion Ag+ au départ : 0,1*0,1 = 0,01 mol donc 0,01 mol d'électrons sera mis en jeu. La charge d'une mole d'électrons est 96500 C soit ici une quantité d'électricité égale à 96500*0,01 = 965 C. durée de
fonctionnement 965/ 210-3 = 482 500 s = 134 heures.
[Cu2+]=0,055/0,1 = 0,55 mol/L.
|
||||||||||||||||||||
|
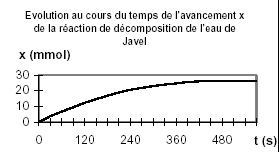
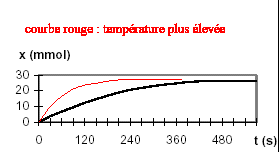
L’eau de Javel est une solution d’ions hypochlorite ClO-(aq), d’ions chlorure Cl-(aq), et d’ions sodium Na+(aq). On utilise une solution commerciale S0 d’eau de Javel achetée en berlingot, dont le volume est V = 250 mL. L’eau de Javel se décompose lentement selon une transformation totale modélisée par la réaction d’équation : 2 ClO-(aq) = 2 Cl-(aq) + O2(g) réaction (1) Pour étudier la cinétique de la réaction (1) en présence d’un catalyseur, on dilue la solution commerciale S0 afin d’obtenir un volume V1= 100,0 mL d’une solution S1 d’eau de Javel cinq fois moins concentrée. On déclenche un chronomètre au moment où l’on introduit le catalyseur dans le système chimique étudié. On mesure alors, à différentes dates, le volume de dioxygène V(O2)oo dégagé dans des conditions telles que le volume molaire soit : Vm = 22,4 L.mol-1. A la fin de la transformation, le volume de dioxygène mesuré est V(O2)oo= 295 mL.
corrigé
xf =V(O2)oo / Vm =0,295/22,4 =0,0132 mol C1V1 -2xf =0 ; C1V1 =2xf ; C1=2xf / V1= 2V(O2)oo / (VmV1)= 2*0,0132 / 0,1 = 0,263 mol/L C0 = 5*0,263 = 1,31 mol/L vitesse volumique de la réaction v=1/V1 dnO2/dt = dx/dt la vitesse volumique diminue au cours du temps car la concentration du réactif diminue : la valeur de cette vitesse est donnée par la pente de la tangente à la courbe x=f(t) ; elle est maximale au départ et nulle au bout d'un temps supérieur à 500 s ( tangente horizontale)
|
||||||||||||||||||||
|
Oscillations dans un circuit LC idéal 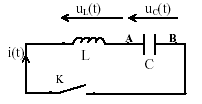 Le condensateur est initialement chargé sous une tension U0. A un instant pris comme origine des dates, on ferme l'interupteur K et on suit l'évolution de la charge q(t) portée par l'armature A du condensateur. On néglige la résistance.
corrigé uC(t) = q(t) / C ; uL(t) = Ldi/dt avec i = dq(t) / dt et di(t)/dt=d²q(t) /dt² ; uL(t) = Ld²q(t) /dt² uC(t) + uL(t) =0 ; q(t) / C + Ld²q(t) /dt² =0 d²q(t) /dt² +1/(LC)q(t)=0 on pose
w²0
= 1/LC et T0= 2p(LC)½.
q'(t) = -Qm w0 sin(w0t) ; q"(t) = -Qm w²0 cos(w0t) repport de q(t) et q"(t) dans l'équation différentielle : -Qm w²0 cos(w0t) + Qm /(LC) cos(w0t)=0 -Qm w²0 cos(w0t) + Qm w²0 cos(w0t)=0 l'égalité est vérifiée donc q(t)=Qm cos(w0t) est solution de l'équation différentielle Qm représente l'amplitude de la charge, sa valeur maximale c'est à dire Q0=CU0. Q0= 2 10-6*10 = 2 10-5 C. w²0 =1/(0,02*2 10-6)= 25 106
soit w0 = 5 103
rad/s.
i(t) = dq(t) / dt = -Qm w0 sin(w0t) = -CU0 (LC)-½ sin(w0t)= -U0L-½ C½ sin(w0t) amplitude Im = U0L-½ C½ = 10(0,02)-½ (2 10-6)½=10*7,07*1,41 10-3 = 0,1 A. en présence d'une résistance, les oscillations s'amortissent et l'amplitude diminue.
|
||||||||||||||||||||
|
datation d'une roche : La méthode potasium-argon permet de dater les roches dont la teneur en potassium est significativ dans une gamme d'âges de trois milliards d'années àquelques dizaines de milliers d'années. Les roches volcaniques contiennent l'isotope 40 du potassium ; ce dernier est radioactif et se désintègre en argon 40 avec une demi-vie ou période t½= 1,4 109 ans. L'agon est un gaz qui est en général retenu par la roche. Lors d'une éruption la roche perd le'argon 40 : c'est le dégazage. A la date de l'éruption la lave ne contient donc plus d'argon. Au cours du temps l'argon 40 s'accumule à nouveau dans la roche alors que le potassium 40 disparaît peu à peu. On considère les masses des atomes de potassium 40 et d'argon 40 identiques.
corrigé deux noyaux isotopes ne diffèrent que par leur nombre de neutrons ( ils ont le même numéro atomique Z) 4019K : Z=19 , numéro atomique caractéristique de l'élément chimique potassium 19 protons; 40-19 = 21 neutrons. dans le noyau. 4019K = 4018Ar + 01e (positon) radioactivité de type b+. un atome de potassium 40 se transforme en un atome d'argon 40. En considérant les masses des atomes de potasium 40 et d'argon 40 identiques m0 = m+m' = 1,6 10-3 g loi de décroissance radioactive N(t) = N0 e-lt. à t½, la moitié des noyaux initiaux de potassium 40 a disparu : N(t½) = ½N0 . ½N0 =N0 e-lt½ ; 0,5 = e-lt½ ; ln2 = lt½. à la date t : N(t) est proportionnelle à m : N(t) = masse m (g) * nombre d'Avogadro / masse molaire potassium 40 à la date t0 : N(t=0) = masse m0 (g) * nombre d'Avogadro / masse molaire potassium 40 N(t) / N0 = m / m0 ; m=m0 e-lt avec l = ln2 / t½ ln( m/m0)= -lt= -ln2 t / t½ t= t½ ln (m0/m)/ln2 = 1,4 109 * ln(1,6/1,4)/0,693 = 2,7 108 ans.
|
||||||||||||||||||||
|
Chute verticale d'une bille : Une petite bille de masse m, de rayon r est totalement immergée dans un liquide de masse volumique r ; elle est abandonnée d'un point O, sans vitesse initiale à l'instant t=0. L'axe z est vertical, orienté vers le bas; son origine est O. 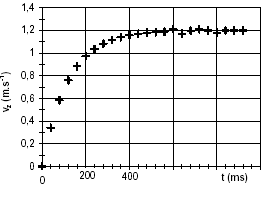
corrigé 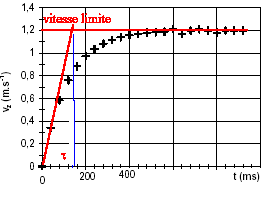
l'asymptote horizontale donne la vitesse limite vL=1,2 m/s. l'intersection de la tangente à l'origine avec l'asymptote donne le temps caractéristique t = 140 ms = 0,14 s. le vecteur accélération est la dérivée du vecteur vitesse par rapport au temps; ces deux vecteurs sont portés par la verticale. La relation entre les valeurs algébriques est a= dv/dt ; la vitesse a le sens du mouvement ; la valeur de la vitesse augmente jusqu' à 1,2 m/s ; la variation de la vitesse est positive, donc l'accélération a le sens du mouvement. Graphiquement , la valeur de l'accélération est égale au coefficient directeur de la tangente à la courbe à la date t. cette valeur diminue, la tangente à la courbe se rapproche de l'horizontale lorsque le temps augmente. lorsque la vitesse limite est atteinte, l'accélération est nulle et le mouvement est rectiligne uniforme. à t=0 on trouve :
a=1,2/ 0,14 = 8,6
m/s².
Au cours de la chute la somme vectorielle des forces appliquées à la bille est égale au produit de la masse de la bille (kg) par l'accélération du centre d'inertie de la bille (seconde loi de Newton).
projection sur un axe vertical vers le bas : mg - rg4/3pr3 -kv = mdv/dt dv/dt = g(1- r/rbille) -k/mv A= g(1- r/rbille) exprimé en m/s² ; B= k/m exprimé en s-1. lorsque la vitesse limite est atteinte dv/dt = 0 et A-BvL=0 soit vL= A/B= 1,2 ou A= 1,2 B. à t=0 ; [dv/dt]t=0
= A car la vitesse initiale est nulle A= 8,6 m/s² ( question 1) et B= 7,16 s-1.
dérivée par rapport au temps: dv/dt = bCe -bt repport dans dv/dt = A-Bv : bCe -bt = A-BC(1-e -bt) = A-BC+BCe -b. d'où A-BC=0 soit C= A/B exprimé en m/s ( il s'agit de la vitesse limite de chute) bC = BC soit b=B , inverse du temps caractéristique. Dans le cas d'une chute libre dans le vide: - il n'y a pas de vitesse limite de chute, la bille n'est soumise qu'à son poids l'accélération est g=9,8 m/s² au niveau du sol terrestre vitesse = g t et hauteur de chute = ½ g t².
|
||||||||||||||||||||
|
|