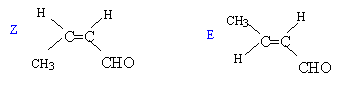|
d'après BTS biotechnologie 03 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||
| .
. |
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|
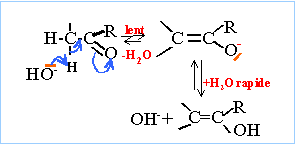
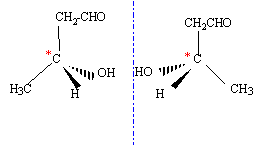
On considère les deux composés organiques suivants : CH3-CHO (a) et le 2,2-diméthylpropanal (a')
corrigé (a) : éthanal ; CH3-C(CH3)2-CHO ; aldehyde (a) possède deux hydrogène en a du groupe carbonyle ; l'atome d'oxygène est attracteur d'électrons et en conséquence la liaison C-H en a est déficitaire en électrons : d'où la mobilité de l'hydrogène en a.
la déshydratation de (b) conduit à des alcènes :
(a') ne possède pas d'hydrogène en a du groupe carbonyle.
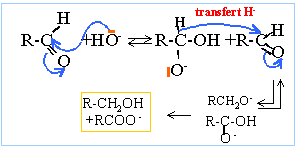
ion 2,2-diméthylpropanoate ; 2,2-diméthylpropan-1-ol dismutation : l'aldehyde joue un double rôle : celui d'oxydant qui se réduit en alcool celui de réducteur qui s'oxyde en ion carboxylate
|
||||||||||||||||||||
|
La désintégration du bismuth 21283Bi à partir de son niveau fondamental conduit à un noyau de thalium 20881Tl à son niveau fondamental ou excité.
 Données : h=6,62 10-34 Js ; c= 3 108 m/s ; 1 eV= 1,6 10-19 J ; 1 u = 1,66 10-27 kg. masse des nucléides (u) : 21283Bi: 211,991 271 ; 20881Tl : 207,982 006 ; 42He : 4,002 603. corrigé 21283Bi-->20881Tl* + 42He radioactivité de type a. suivi de : 20881Tl* --> 20881Tl + photon g. désexcitation du noyau fils conservation du nombre de nucléon : 212 = 208+4 conservation de la charge : 83 = 81 +2 variation de masse : |Dm|=211,991 271-(207,982 006+4,002 603)=6,662 10-3 u 6,662 10-3 *1,66 10-27 = 1,1 10-29 kg. énergie libérée = |Dm| c² = 1,1 10-29*(3 108 )²= 9,95 10-23 J 9,95 10-23 /1,6 10-19 =6,22 106 eV= 6,22 MeV. flèches 7 à 15 : désexcitation du noyau fils flèches 1 à 6 : énergie emportée par la particule a sous forme cinétique transition 8 : D E= 0,33 MeV = 0,33 106 eV = 3,3 105 eV 3,3 105 *1,6 10-19 = 5,328 10-14 J D E=hc/l d'où l = hc / D E =6,62 10-34 * 3 108 / 5,328 10-14 =3,73 10-12 m. transition 3 : D E= 6,22-0,33= 5,89 MeV = 5,89 106 eV 5,89 106 *1,6 10-19 = 9,42 10-13 J dans l'hypothèse d'une particule non relativiste
|
|||||||||||||||||||||
|
On dose par conductimétrie une solution S d'ammoniac NH3 de concentration cb par une solution d'acide chlorhydrique de concentration ca= 0,1 mol/L. La solution S à doser se trouve dans la burette. On verse dans un bécher 10 mL de la solution acide auxquels on ajoute 90 mL d'eau distillée. Dans ce bécher plonge la cellule conductimétrique. On suit l'évolution de la conductance au cours du dosage.
constante de cellule K= 0,01 m ; conductivité l en Sm²mol-1 : l H3O+ = 35 10-3 ; l NH4+ = 7,4 10-3 ; l Cl- = 7,6 10-3 . corrigé 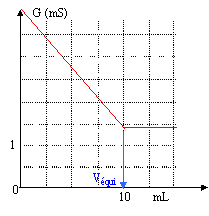
NH3+H3O++Cl-= NH4++Cl- + H2O à l'équivalence les quantités de matière des réactifs sont en proportions stoéchiomètriques cava = cbvéqui cb = 0,1*10 / 10 = 0,1 mol/L. en ajoutant 90 mL d'eau distillée dans le bécher, on peut considérer que le volume de cette solution est à peu près constant ( V= 0,1 L) au cours du dosage. conductivité de la solution du bécher avant l'équivalence : s = l H3O+ [H3O+] + l Cl- [Cl-]+l NH4+ [NH4+] avec [Cl-] = cava/V = 0,1*0,01/0,1 = 0,01 mol/L= 10 mol m-3. [NH4+] = 103cbvNH3/V =103vNH3mol m-3. [H3O+] initial = cava/V = 0,1*0,01/0,1 = 0,01 mol/L= 10 mol m-3. [H3O+] = 10-[NH4+] = 10-103vNH3mol m-3. s =35 10-3(10-103vNH3) + 7,6 10-3 *10 + 7,4 10-3103vNH3. s =0,35 -35 vNH3+ 0,076 + 7,4 vNH3. s =0,426 -27,6 vNH3. fonction affine décroissante ( vNH3. en litre) conductivité initiale : 0,426 Sm-1 ; conductance initiale G= Ks =0,01*0,426 = 4,26 10-3 siemens (S) conductivité de la solution du bécher après l'équivalence : s = l Cl- [Cl-]+l NH4+ [NH4+] s = 7,6 10-3 *10 + 7,4 10-3103véqui. s = 0,076 + 7,4 véqui valeur constante valeur à l'équivalence s =0,076 + 7,4*0,01 =0,15 Sm-1 ; conductance G= 0,15*0,01 = 1,5 10-3 siemens (S)
|
|||||||||||||||||||||
|
|