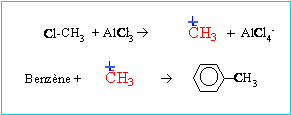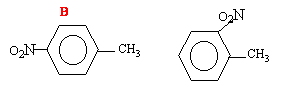|
d'après BTS biochimiste 03 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||
|
|
A l'aide d'un spectrophotomètre, on réalise une série de mesures d'absorbance A de solutions de violet cristallisé, àla longueur d'onde l= 580 nm. La cuve a une épaisseur l =1 cm. On obtient les résultats suivants en fonction de la concentration massique r des solutions :
corrigé La transmission T est définie comme le rapport de l'intensité transmise I à l'intensité incidente I0. T = I / I0 ; log T= -A. A= log (I0/I) = elc ( A est l'absorbance ou densité optique) où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L). Les solutions colorées présentent une longueur d’onde lumineuse où l’absorption est maximale. Cette longueur d’onde maximale l max ne dépend pas de la concentration, c’est une grandeur caractéristique de l’ion absorbant. Elle est utilisée pour effectuer les mesures photométriques sur des solutions de différentes concentrations.
r /A = 5,8 10-3 g L-1. C/A=5,8 10-3 / masse molaire (g/mol) = 5,8 10-3 /408,19 =1,42 10-5 mol/L = 1,42 10-2 mol m-3. r /A = 1 /(el) avec largeur l = 10-2 m ; 1,42 10-2 = 1/(10-2 e ) = 100 / e soit e = 100 /1,42 10-2 = 104 /1,42 =7042 m2 mol-1. ou bien : 1,42 10-5= 1/(1* e ) soit e = 1/1,42 10-5=70420 Lmol-1 cm-1. si A= 0,531 alors C/A= 1,42 10-5 mol/L soit C= 0,531*1,42 10-5 = 7,54 10-6 mol/L r = 7,54 10-6*408,19 =3,08 10-3 g/L.
|
|||||||||||||||||||||||||||||||||||
|
Le 3215P est un isotope radioactif du phosphore émetteur b-, de période T=14 jours. Il est utilisé dans le traitement de certaines pathologies du sang ; la dose thérapeutique est de 4 106 Bq par kg de masse corporelle à 10% près.
Données : nombre d'Avogadro NA= 6,02 1023 ; 13Al ; 14Si ; 15P ; 16S ; 17Cl ; 18Ar. corrigé 3215P ->3216S + 0-1e conservation du nombre de nucléon : 32 = 32+0 conservation de la charge : 15= 16-1 lT=ln2 =0,693 soit l =0,693 / T = 0,693 / 14 = 4,95 10-2 j-1. 14 j = 14*24*3600 s =1,21 106 s ; l = 0,693 / 1,21 106 =5,73 10-7 s-1. activité pour un patient de 90 kg : 90*4 106 = 3,6 108 Bq nombre d'atomes de 3215P correspondant : A= l N soit N=A/ l. N= 3,6 108 / 5,73 10-7 = 6,28 1014 atomes Qté de matière en mol : 6,28 1014 / NA= 6,28 1014 / 6,02 1023= 1,04 10-9 mol masse de 3215P : Qté de matière * masse molaire (g/mol) = 1,04 10-9 *32 = 3,34 10-8 g. A= A0 e-lt ; avec l t = 4,95 10-2*10 =0,495 et A10 = 3,6 108 e(-0,495)=2,19 108 Bq. pour une patiente de 58 kg : A= 4 106*58 = 2,3 108 Bq la capsule précédente peut être utilisée.
|
||||||||||||||||||||||||||||||||||||
|
On étudie à 25°C, l'équilibre mis en jeu dans la pile Daniell Zn(s) + Cu2+ = Cu(s) + Zn2+.
R= 8,31 J K-1 mol-1 ; 1F = 96500 C corrigé DfH0 = DfH0(Zn2+)- DfH0(Cu2+)= -153,4-65,7= -219,1 kJ/mol= -219,1 103J/mol DfS0 = S0 (Zn2+) + S0 (Cu)-S0 (Cu2+)-S0 (Zn)= -109,6+33,2-(-97,1)-41,6 = -20,9 Jmol-1 K-1 DfG 0 = DfH0-TDfS0 = -219,1 103-298*(-20,9)= -212,87 103 J/mol = -212,87 kJ/mol affinité A = -DfG 0 =212,87 kJ/mol l'affinité étant positive, la réaction évolue spontanément dans le sens direct, de gauche à droite. constante d'équilibre K= [Zn2+]éq/[Cu2+]éq A= RT lnK soit ln K=A/(RT)= 212,87 103 / (8,31*298)=85,96 K= 2,15 1037 valeur très grande, donc la réaction est totale
le zinc est le réducteur le plus fort et l'ion cuivre II constitue l'oxydant le plus fort le zinc s'oxyde : Zn (s)= Zn2+ + 2 électrons l'ion cuivre II se réduit Cu2+ + 2électrons = Cu(s) Zn(s) + Cu2+ = Cu(s) + Zn2+. fem standart E0 =E0Cu2+/Cu - E0Zn2+/Zn =0,34 -(-0,76 )= 1,1V. - DfG 0 = nFE0 ; DfG 0 = -nFE0 = -2 *96500*1,1 = -2,12 105 J/mol = -212,3 kJ/mol en accord avec la valeur de la question 1.
|
||||||||||||||||||||||||||||||||||||
|
On fait réagir du benzène avec du monochlorométhane en présence de chlorure d'aluminium AlCl3.
corrigé C6H6 +CH3Cl -->C6H5 -CH3 + HCl C6H5 -CH3 : méthylbenzène réaction de Friedel et Crafts, substitution électrophile sur le benzène
On utilise le mélange sulfonitrique ( permet de préparer NO2+) pour une nitration. le groupe méthyl auglmente la densité électronique en ortho et en para ; on obtient donc deux isomères le dérivé para est majoritaire ; le dérivé ortho est minoritaire ( gène stérique entre CH3 et NO2)
6 fois {MnO4- + 8H+ + 5e- = Mn2+ + 4H2O} réduction de l'oxydant 5 fois { NO2-C6H4-CH3 + 2H2O= NO2-C6H4-COOH + 6H+ + 6e-}oxydation du réducteur. 6 MnO4- + 18 H+ + 5 NO2-C6H4-CH3 = 6 Mn2++5 NO2-C6H4-COOH + 14 H2O |
||||||||||||||||||||||||||||||||||||
|
|