|
d'après bac S Pondichéry 2004 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
|
chute libre et parachutisme (6 points)
B- le saut classique. masse du parachutiste et de son équipement m= 80 kg ; le parachutiste s'élance sans vitesse initiale d'une altitude de 1000 m ; le saut se déroule en deux phases.
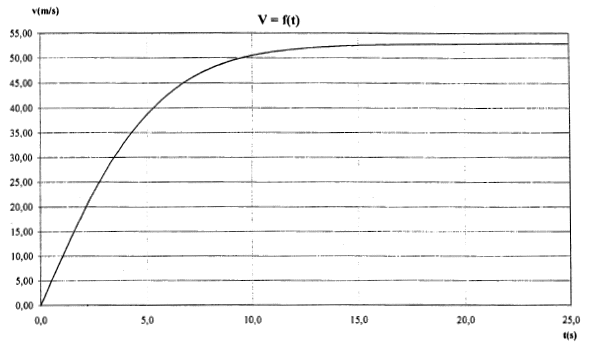
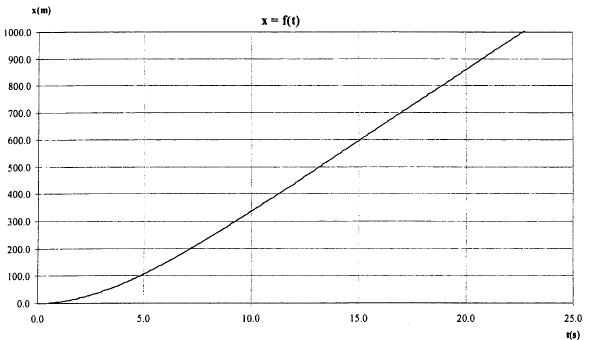
corrigé force de gravitation F = GMtm/(Rt+h)² = mg soit g = GMt/(Rt+h)² masse en kg et distance en mètre. h= 4 104 m ; Mt= 5,97 1024 kg ; Rt= 6,37 106 m ; G= 6,67 10-11 g = 6,67 10-11*5,97 1024 /(6,37 106 +4 104 )² = 9,69 m/s². chute libre : le solide en chute libre n'est soumis qu'à son poids ; l'accélération de son centre d'inertie est égale à la valeur de g à l'altitude considérée. On choisit un axe verticale orienté vers le bas ; l'origine est l'altitude de départ du saut. accélération verticale, vers le bas, valeur g=9,7 m/s² la vitesse est une primitive de l'accélération : v(t) = gt = 9,7 t ( pas de vitesse initiale) 1067/3,6 = 296,4 m/s durée t1 = 296,4 / 9,7 = 30,5 s. distance x parcourue primitive de la vitesse : x=½gt² = 4,85t. x1 = 4,85*30²=4365 m ; h1 = 40 000-4 365 = 35,6 km. l'onde sonore ne transporte pas de matière mais seulement de l'énergie d'où le terme célérité à la place du terme vitesse ( le terme vitesse est lié au transport de matière) 1067 km/h = 296,4 m/s ; température T= 273 + q1. 1193 km/h = 331,39 m/s ; température 273 K 331,39 / 296,4 =1,118 = (273 / T)½. élever au carré 1,25 = 273 / T soit T =273 /1,25 = 218,4 K q1 = 218,4-273 = -54,6°C.
suivant un axe verticale orienté vers le bas, l'origine étant au point de départ du saut, la seconde loi de Newton s'écrit : mg-kv²=mdv/dt ; dv/dt = g-k/m v² avec k/m = 0,28/80 = 3,5 10-3.
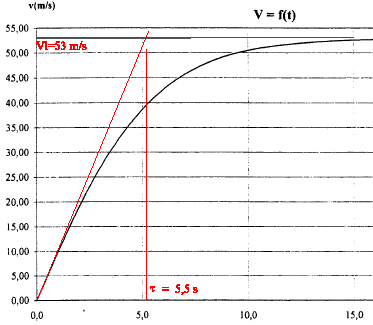
la valeur de l'accélération g est donnée par le coefficient directeur de la tangente à l'origine soit environ 53 /5,5 = 9,7 m/s². méthode d'Euler : d'une part Dv/Dt= a soit vn+1-vn= a Dt (1) avec Dt = 0,1 s d'autre part a=Dv/Dt= 9,8-0,0035 v² (2) v3 = 2,94 m/s ; a3 = 9,77 m/s² (1) donne v4 = v3 + a3Dt = 2,94 + 9,77*0,1 = 3,92 m/s a4 = 9,8 -0,0035 v²4 =9,8-0,0035*3,92² = 9,746 m/s² v5 = v4
+ a4Dt = 3,92 + 9,746*0,1 = 4,895
m/s.
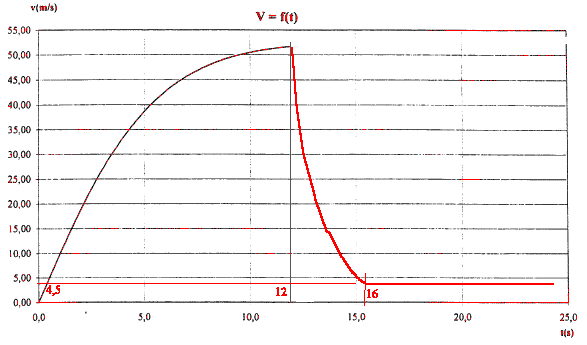
si la vitesse limite est atteinte : dv/dt =0 soit g-k'/m vl² =0 ou k'= mg/ vl² k'= 80*9,8/(4,5²) = 38,7 kg m-1.
|
|||||||||||||||||||||||||
|
Fabrication et titrage de l'aspirine (6 points)
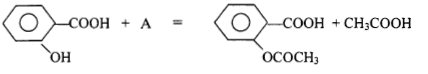
corrigé R'-CH2OH + R-COOH = R-COO-CH2-R' + H2O
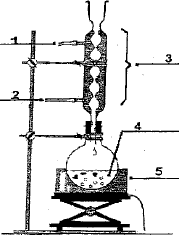
5 : chauffe ballon ; 4 ; ballon ( alcool + anhydride éthanoïque et acide sulfurique) 3 : réfrigérant droit ou colonne Vigreux 2: arrivée de l'eau ; 1 : sortie de l'eau A est l'anhydride éthanoïque CH3-CO-O-OC-CH3. Qté de matière initiale : acide salycilique : 5/138= 0,0362 mol ( en défaut) réactif limitant anhydride éthanoïque : 7*1,08/102 = 0,0741 mol ( en excès) on peut espérer obtenir au mieux 0,0362 mol d'aspirine soit une masse : 0,0362*180 = 6,51 g. rendement
=4,2/6,51*100 = 64,5
%.
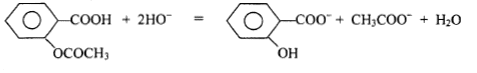
H3O+ + HO- = 2H2O. quantité de matière d'ion hydroxyde titrés par l'acide chlorhydrique dans 10 mL S2. V1C1 = 7,5 10-3*0,05 =3,75 10-4 mol et dans 250 mL de S2 : 25*3,75 10-4 = 9,375 10-3 mol d'ion hydroxyde en excès Qté d'ion hydroxyde ayant réagi avec l'aspirine : 0,02-9,375 10-3 =1,062 10-2 mol or une mole d'aspirine réagit avec deux moles d'ions hydroxyde d'où la quantité de matière d'aspirine : 1,062 10-2 / 2 = 5,31 10-3 mol masse d'aspirine dans 1 g : 5,31 10-3 *180 = 0,956 g. écart faible : 4,4%, erreurs commises lors de la prise de 10 mL à la pipette ou lecture sur la burette lors du dosage,ou lors de la pesée d'un gramme d'aspirine. |
||||||||||||||||||||||||||
|
Lampe à vapeur de sodium ( 4 points) h= 6,62 10-34 Js ; c= 3 108 m/s ; e= 1,6 10-19 C.
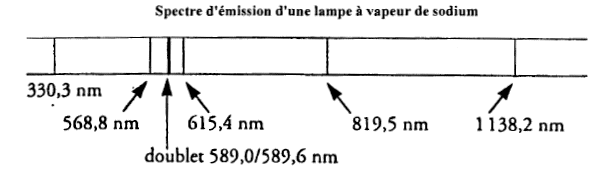
corrigé domaine visible [400 nm ; 800 nm] donc les raies à 568,8 ; 589 ; 589,6 ; 615 nm IR : raies situées à 819,5 et 1138,2 nm UV raie à 330,3 nm. La lumière est polychromatique : on observe plusieures raies ayant des fréquences, donc des couleurs différentes. fréquence de la raie à 589 nm : f= c/l = 3 108 / 589 10-9 = 5,1 1014 Hz. h est la
constante de Plank et e la charge élémentaire
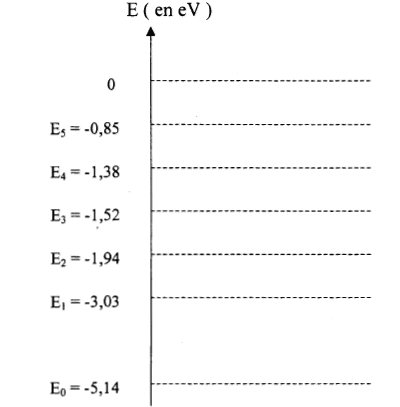
les niveaux d'énergie sont discontinus donc spectres de raies d'émission ou d'absorption D E= hc/l = 6,62 10-34*3 108 /589 10-9 =3,372 10-19 J =3,372 10-19 /1,6 10-19 eV =2,107 eV. transition du
niveau E0 au niveau E1.
le photon peut interagir avec l'atome si son énergie correspond à la différence d'énergie entre deux niveaux de l'atome ou bien si le photon est suffisamment énergétique pour ionisé l'atome. l'atome de sodium gagne de l'énergie, il s'agit d'une absorption transition du niveau E1 au niveau E2. |
||||||||||||||||||||||||||
|
|