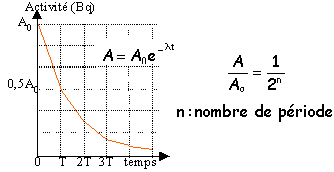|
solution d'ammoniac- dureté d'une eau d'après bac STL biochimie génie biologique 2003 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||
|
|||
|
|
L’isotope 131 de l'iode, 131I a une période radioactive (ou temps demi-vie) T = 8,0 jours. Il subit une désintégration radioactive de type b-. On dispose d’un échantillon constitué à l’instant t0 = 0,00 jour d'un nombre N0 = 6,0 1020 noyaux d’iode 131 obtenu par un prélèvement d'une masse d'environ 0,1 g.
corrigé La radioactivité est l’émission spontanée par certains noyaux de particules a, b, et parfois de rayonnement électromagnétique. l’équation de la réaction : 13153I = AZX + 0-1e conservation du nombre de masse : 131 = A + 0 d'où A=131 conservations du nombre de charge : 53 = Z-1 d'où Z=54 activité d’un échantillon radioactif : c’est le nombre de désintégration radioactives chaque seconde. Elle se mesure par un compteur Geiger-Muller et se mesure en Becquerels (Bq). L’activité de la source : A0 = l N0 où l est la constante radioactive l = ln2 / t½ l = ln2 / (8 * 24 * 3600) = 10-6 s-1. Donc A0 = 10-6 * 6,0 ´ 10 20 = 6,0 10 14 Bq. La désintégration des noyaux : Après 1 durée t½ il reste N(t½) = ½N0 = 3,0 10 20 noyaux. Après 2 t ½ il reste N(2t½) = 0,5 N(t½) = 1,5 10 20 noyaux. Après 3 t ½ vie il reste N(3t½) = 0,5 N(2t½) = 0,75 10 20 noyaux.
N(t) / N0 = 0,2 = e -l t donc ln 0,2 = -l t = - 10-6 t t = ln 0,2 / (- 10-6 ) = 1,61 10 6 s = 447,2 h = 18,6 jours = 19 jours
|
||
|
Pour protéger les jantes des roues de moto de la corrosion, on les recouvre d'un dépôt de chrome. La jante constitue l'électrode reliée à la borne négative du générateur, l'autre électrode est une barre de chrome. L’ensemble est immergé dans une cuve à électrolyse contenant une solution de sulfate de chrome (III) (2 Cr3+, 3 SO4 2- ). L'électrolyse s'effectue, en courant continu, sous une tension U = 2,2 V. L'intensité I qui traverse la solution a une valeur égale à 20 kA. L'opération dure 30 secondes. La cuve possède une résistance interne r égale à 1,2 10-5 W.
corrigé 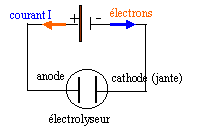
réduction des ions chrome III à l’électrode négative. Cr 3+ + 3 e- = Cr le chrome métal se forme là où les électrons arrivent c’est à dire coté de l’électrode négative du générateur. Quantité d’électricité Q transportée : coulomb Q = intensité (A) * durée (seconde) Q=20 000* 30 = 6 105 coulombs. masse de dépôt de Cr déposée sur la jante : nombre de mole d’électrons échangés : 600 000 / 96500 = 6,22 mol donc 6,22 / 3 = 2,07 mol de chrome déposé masse = 2,07 * 52 = 108 g. Energie consommée et énergie dissipée par effet joule. Energie électrique nécessaire pour cette électrolyse : Wélec reçue = U I t = 2,2*20 000*30 = 1,32 106 J énergie consommée par effet joule : Wjoule = r I ² t =1,2 10-5*(2 104)2*30=1,44 105 J.
|
|||
|
corrigé Schéma de Lewis : 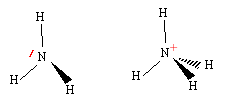
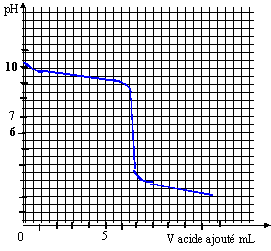
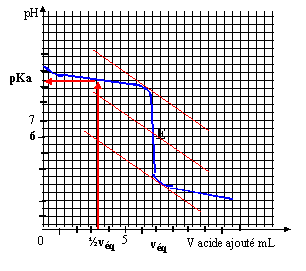
Géométrie de la molécule d’ammoniac NH3 du type AX3E : pyramidal à base triangulaire Géométrie de l’ion ammonium NH4+ du type AX4 : c’est un tétraèdre avec des angles entre les liaisons de 109°28’ Les angles de liaison de la molécule d’ammoniac seront plus resserrés que ceux de l’ion. car le doublet non liant de l’ammoniac repousse davantage les autres doublets liants. Titrage d’une solution d’ammoniac sur par pH-métrie NH3 + (H3O+ + Cl-) =NH4+ + Cl- + 2H2O
Grâce à la méthode des tangentes, on trouve : pHeq = 6 ; veq = 7 mL L’ammoniac et l’acide chlorhydrique réagissant mole pour mole, à l’équivalence : soit ca veq = cb vb La solution d’ammoniac a pour concentration : cb = 7*0,01/10= 7 10-3 mol.L-1 Pour obtenir la valeur du pKa du couple NH4+/NH3, il suffit de relever la valeur du pH à la ½ équivalence. On a donc ici pKa du couple NH4+/NH3 = 9,2. Solution tampon La valeur du pH désiré pour la solution tampon n’est pas égale au pKa , il faut donc développer les calculs : pH = pKa + log [NH3]/[NH4+] log [NH3]/[NH4+] = 9-9,2 = 0,2 d'où [NH3]/[NH4+] = 1,58 conservation de la matière de l'élément azote : [NH3]+[NH4+] =0,01 1,58 [NH4+] + [NH4+] =0,01 d'où [NH4+] = 3,88 10-3 mol/L en conséquence on a apporté 3,88 10-3 mol d'acide chlorhydrique à 1 mol/L soit un volume de 3,88 mL ( environ 4 mL)
|
|||
corrigé La structure électronique du calcium est 1s2 2s2 2p6 3s2 3p6 4s2 soit (K)2 (L)8 (M)8 (N)2 l’atome perdra 2 électrons pour devenir l’ion Ca2+. Dans l’erlenmeyer, il y a : · avant ajout d’EDTA : des ions Ca2+ · avant l’équivalence : des ions complexes [CaNET]- de couleur rouge bordeaux, des ions complexes incolores [CaY]2- · après l’équivalence : le NET sous forme libre de couleur bleue, des ions complexes incolores [CaY]2- Le milieu réactionnel passera du rouge au bleu, le complexe [CaY]2- est le plus stable. Ainsi une fois complexé, il n’y a plus d’ions Ca2+ libres, et on observe le changement de couleur. Ca2+ + Y4-= [CaY]2-. Une mole d’ions Ca2+ réagit avec une mole d’EDTA, donc à l’équivalence : d'où [Ca2+]V = c1.Veq [Ca2+] =0,01*19/50=38 10-4 mol/L On obtient donc une dureté de l’eau de 38 °TH. |
|||
|
|
|||
|
|