|
titrage acido-basique- solubilité d'après bac STL biochimie génie biologique 2002 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||
|
||||||||||||||||||||
|
|
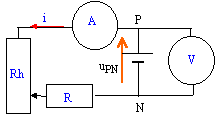
On associe en série une pile, un rhéostat, une résistance de protection, un ampéremètre et un voltmètre permettant de mesurer la tension uPN aux bornes de la pile.
corrigé
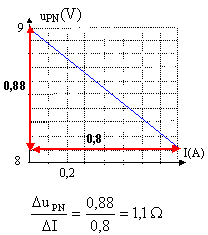
uPN = E-rI tension aux bornes du moteur :uMoteur = E'+r'I tension aux bornes du résistor : urésistor = RI moteur et résistor en série : uMoteur + urésistor =uPN E-rI = E'+r'I +RI d'où I= (E-E') / (r+r'+R) = (9-4) / (1,2+2+20) = 0,213 A. puissance reçue par le moteur : (E'+r'I) I= (4+2*0,213)*0,213= 0,943 W. puissance joule dans le moteur : r'I²= 2*0,213²= 0,091 W. puissance joule dans le circuit : (r+r'+R)I²= (1,2+2+20)*0,213²=1,05 W.
|
|||||||||||||||||||
|
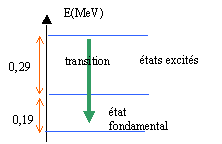
Un atome de radium 22688Ra est radioactif; il conduit au radon Rn et à noyau d'hélium 42He
corrigé radioactivité de type a 22688Ra = AZX + 42He conservation de la charge : 88=Z+2 d'où Z=86 , élément radon Rn conservation du nombre de masse : 226=A+4 d'où A=222. différence d'énergie associée à la transition : DE=0,48 eV= 0,48*1,6 10-19 J= 0,768 10-19 J fréquence de la radiation émise : n =DE / h = 0,768 10-19 / 6,62 10-34 = 1,16 1014 Hz longueur d'onde dans le vide l= c/n =3 108 / 1,16 1014 = 2,58 10-6 m = 2,58 10-3 mm la radiation appartient au domaine UV 3240 ans = 2 périodes au bout d'une période le nombre d'atomes radioactifs est divisé par 2 au bout de 2 périodes le nombre d'atomes radioactifs est divisé par 4 masse de radium au bour de 2 périodes : 1/4 = 0,25 mg.
|
||||||||||||||||||||
|
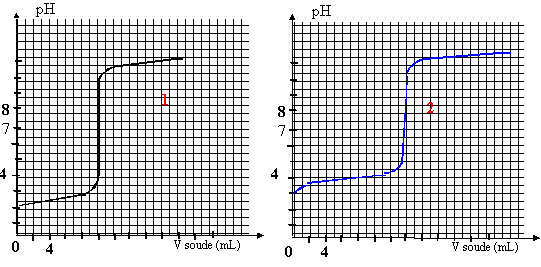
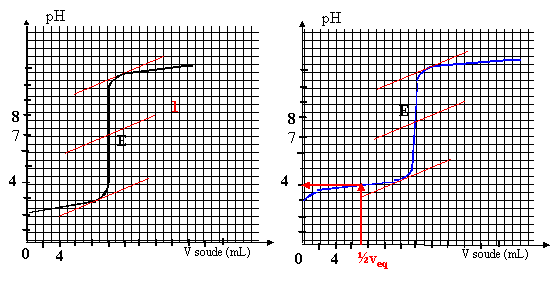
On titre un volume V1= 20 mL d'une solution d'acide HA1 ( courbe 1) de concentration C1 puis un volume V2= 20 mL d'une solution d'acide HA2 ( courbe 2)de concetration C2 avec de l'hydroxyde de sodium (soude) de concentration c0=0,01 mol/L. On suit au pHmètre les variations de pH.
corrigé HA1 est un acide fort, le pH à l'équivalence est égal à 7. HA2 est un acide faible, le pH à l'équivalence est différent de 7.
HA1 + H2O--> A1- + H3O+ réaction totale HA2 + H2O= A2- + H3O+ réaction très limitée constante d'acidité Ka= [A2-][H3O+]/[HA2] HA1 +HO--->A1- +H2O à l'équivalence la quantité de matière d'acide est égale à la quantité de matière de soude ajoutée C1 V1 = c0V1équi avec V1équi = 10 mL C1 = 0,01*10/20 = 0,005 mol/L. HA2 +HO--->A2- +H2O à l'équivalence la quantité de matière d'acide est égale à la quantité de matière de soude ajoutée C2 V2 = c0V2équi avec V2équi = 14 mL C2 = 0,01*14/20 = 0,007 mol/L. on trouve graphiquement le pKa de l'acide faible en déterminant le pH à la demi-équivalence ( courbe 2): pKa = 4. Une solution tampon modère les variations de pH dus à l'ajout modéré d'acide ou de base forte. le pH d'une solution tampon ne varie pas par dilution Une solution tampon doit contenir un couple acide base telle que l'acide et la base conjuguée soit en quantité égale. prendre l'acide HA2 et arrèter le dosage à la demi-équivalence.
|
||||||||||||||||||||
|
La première demi-pile est constituée d'une électrode de platine plongeant dans une solution de permanganate de potassium K+ + MnO4- acidifiée dans laquelle [MnO4-]=0,01 mol/L ; [Mn2+]=0,02 mol/L ; [H3O+]=0,01 mol/L. L'autre demi-pile est une électrode d'argent plongeant dans une solution de nitrate d'argent Ag++ NO3- telle que [Ag+]=0,1 mol/L. L'étude est faite à 25°C.
potentiel standart des couple MnO4-/Mn2+ : 1,51 V ; Ag+/Ag : 0,8 V ; produit de solubilité Ag2SO4 : Ks= 2,4 10-5. corrigé MnO4-+ 8H++5e-=Mn2++4H2O E1= E10 + 0,06 / 5 log [MnO4-][H+]8/[Mn2+] E1= 1,51+0,06/5 log(0,01*10-16/0,02)=1,51-0,195 = 1,314 V Ag++e- = Ag(s) E2= E20 + 0,06 log [Ag+] = 0,8+0,06log0,1=0,74 V fem de la pile : E=1,314-0,74 = 0,574 V. MnO4-+ 8H++5e-=Mn2++4H2O réduction de l'oxydant le plus fort (borne positive de la pile) 5 Ag(s) = 5Ag++5e- oxydation de l'argent , réducteur le plus fort( borne négative de la pile) bilan : MnO4-+ 8H++ 5 Ag(s) = Mn2++5Ag++4H2O Ag2SO4 (s)= 2Ag+ + SO42- avec s=[Ag+]=2[SO42-] Ks = [Ag+]2[SO42-] =s2 ½s= ½s3 = 2,4 10-5. d'où la solubilité s= racine cubique(4,8 10-5)=0,0364 mol/L. demi pile n°3 : 2Ag++2e- = 2Ag(s) et Ag2SO4 (s)= 2Ag+ + SO42- Ag2SO4 (s) +2e- = 2Ag(s) + SO42- ; E3= E30 + 0,03 log 1/[SO42-] E3= E20 + 0,03 log [Ag+]2 =E20 + 0,03 log [Ag+]2 [SO42-] / [SO42-] E3= E20 + 0,03 log Ks / [SO42-]= E20 + 0,03 log Ks + 0,03 log1/[SO42-] E3= 0,8 +0,03 log( 2,4 10-5)+ 0,03 log1/[SO42-] E3= 0,661 + 0,03 log(1/[0,5*0,0364])= 0,661+0,03*1,74 = 0,713 V. tant que la solution reste saturée en sulfate d'argent la concentration en ion Ag+ reste constante. |
||||||||||||||||||||
|
|
||||||||||||||||||||
|
|