|
d'après bac France juin 2004 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||
|
||||||||||||||||||||
|
|
L'eau de Dakin est un antiseptique utilisé pour le lavage des plaies et des muqueuses. Elle a une couleur rose et une odeur chlorée. L'étiquette du flacon mentionne les principes actifs pour un volume V = 100 mL : "solution concentrée d'hypochlorite de sodium, quantité correspondant à 0,500 g de chlore actif - permanganate de potassium 0,0010 g - dihydrogénophosphate de sodium dihydraté - eau purifiée". En outre, l'eau de Dakin contient des ions chlorure. Cet exercice propose de vérifier une partie des indications de l'étiquette. La question 1 est indépendante des questions 2 et 3. Données :O : 16 ; Na : 23 ; Cl : 35,5 ; K : 39 ; Mn : 55 g/mol Solubilité du dichlore à 20 °C : dans l'eau : 8 g.L-1 ; dans l'eau salée : très peu soluble. Volume molaire gazeux dans les conditions de l'expérience : VM = 24,0 L. mol-1.
M: masse molaire du permanganate de potassium. : 39+55+4*16 = 158 g/mol masse de solide à peser : masse molaire (g*/mol) * Qté de matière (mol) m = 158* 5 10-3 = 0,79 g.
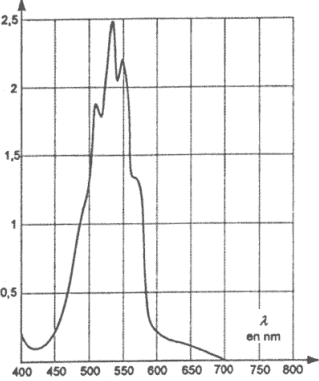
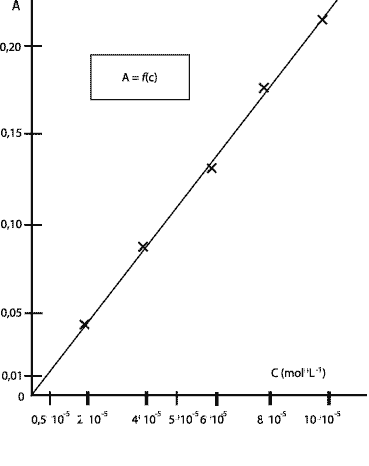
La courbe est une droite qui passe par l'origine donc A et c sont proportionnelles. coefficient directeur de la droite : 0,221 / 10-4 = 2,2 103 L/mol soit A= 2,2 103 c. On choisit la longueur d'onde correspondant au maximum d'absorption pour la solution de permanganate de potassium. lecture graphique : environ 530 nm. Sur ce spectre l'absorbance à l = 530 nm vaut 2,5 valeur bien supérieure aux absorbances du tableau précédent. Or l'absorbance est proportionnelle à la concentration de la solution. Donc ce spectre a été réalisé avec une solution plus concentrée que celles du tableau. A = 0,14 donc cexp = A/ 2,2 103 = 0,14 / 2200 = 6,36 10-5 mol/L D'après l'étiquette cette eau contient m = 0,0010 g de permanganate de potassium pour un volumeV = 0,1 L de solution. Donc 0,010 g dans un litre de solution Qté de matière (mol) = masse (g) / masse molaire (g/mol) = 0,01 / 158 = 6,33 10-5 mol dans 1 L L'écart relatif
vaut : (6,36 -6,33)/6,36 =0,004 ( 0,4%) écart relatif très faible.
En tenant compte de l'écriture de l'équation (1) on peut écrire: 2Cl- = Cl2 + 2e- oxydation de l'ion chlorure 2CIO-+ 4H+ + 2e- = CI2 + 2H2O réduction de ClO- le dichlore est très soluble dans l'eau mais très peu soluble dans l'eau salée : l'eau salée permet de recueillir le dichlore dégagé par déplacement de l'eau salée. Qté de matière dichlore (mol) = volume du gaz (L) / volume molaire des gaz ( L/mol)= 0,17 /24 = 7,08 10-3 mol masse de dichlore : Qté de matière (mol) * masse molaire (g/mol) 7,08 10-3 * 71 = 0,503 g. L'écart relatif est ( 0,503-0,5)/0,5 = 0,006 ( 0,6 %) valeur très faible. Rôle du dihydrogénophosphate de sodium dihydraté. en milieu acide cette eau de Dakin se dénature en libérant du dichlore. en milieu basique, il n'y a pas de dégagement de dichlore : le dihydrogénophosphate de sodium maintient la solution basique et celle-ci peut être conservée.
|
|||||||||||||||||||
| |
||||||||||||||||||||
|
|