QCM ( 4
points).
1. Solution
d'acide nitrique à 12,5 mol / L.
On souhaite préparer 100 mL d'une solution à 2,5 mol / L. Quel est le
facteur de dilution ?
F = 12,5 / 2,5 = 5. Réponse
a.
Quel volume de solution mère faut-l prélever ?
100 / 5 = 20 mL.
Réponse b.
2. 146C. Quel
est le nombre d'électrons présents dans le nuage électronique ?
6 électrons. Réponse a.
Quel est le nombre de neutrons dans le noyau ?
14-6 = 8 neutrons dans le noyau. Réponse c.
3. Titrage d'un diacide C4H4O4
noté H2A par la soude.
H2A aq + 2HO-aq --> A-aq + 2H2O(l).
Relation entre les réactifs à l'équivalence : n(HO-) = 2 n(H2A).
Masse molaire de cet acide : M = 4 (12+1+16) = 116 g / mol. Réponse b.
4. Indiquer le groupe fonctionnel
d'un alcool.
-OH. Réponse
a.
5. Un échantillon
d'iode 131 radioactif contient initialement 100 000 noyaux. Sa demi-vie
est de 8 jours.Combien de noyaux sont -ils présents au bout de 32 jours
?
Au bout de 8 jours : 50 000 ; au bout de 2 x8 =16 jours : 25 000 ; au
bout de 3 x8 = 24 jours : 12500 ;
au bout de 4x8 = 32 jours : 6250. Réponse
a.
Etude d'une pile. 3
points.
Capacité d'une pile bouton : 33 mAh soit 119 C.
L'une des électrode solide est Ag
2O et l'autre est une lame
de zinc. L'électrolyte est l'hydroxyde de potassium.
Réduction de Ag
2O au pôle positif : Ag
2O(s) + H
2O(l)
+ 2e
- --> 2Ag(s) +2HO
-aq.
A pôle négatif : Zn(s) +
2HO-aq
--> ZnO(s) + H2O(l) + 2e-.
Le zinc est le réducteur, il s'oxyde en libérant des électrons ; le
zinc est le pôle négatif de la pile.
L'électrolyte est une base, susceptible de libérer des ions HO-.
Le pH de cet électrolyte est supérieur à 7.
Equation de fonctionnement de la pile : ajouter les desu demi-équations
puis simplifier.
Ag2O(s)
+ H2O(l) + 2e-
+Zn(s) + 2HO-aq--> 2Ag(s) +2HO-aq+ZnO(s) + H2O(l) + 2e-.
Ag2O(s) +Zn(s)-->2Ag(s) +ZnO(s).
Quantité de matière d'électricité : 119 C.
Quantité de matière d'électrons n(e-) = 119 / 96500 =0,00123
mol.
Quantité de matière de zinc = quantité de matière Ag2O =
0,00123 / 2 = 6,17 10-4 mol.
Masse de zinc : 6,17 10-4 x 65,4 =0,040 g = 40 mg.
Masse d'oxyde d'argent ( M= 108*2+16=232 g/mol) : 6,17 10-4 x 232 =0,147 g = 147 mg.
Masse des deux électrodes : 187 mg~0,2 g.
Chimie organique.(8,5 points).
1. Un isomère définit des composés ayant la même formule brute ( donc même
masse molaire) mais des formules semi-développées différentes. Des
molécules de deux isomères ne sont pas superposables.
Des isomères ont des propriétés physique, chimique et biologique
différentes. ( masse volumique , température de fusion différentes).
Une seule liaison différente entre deux atomes suffit pour que deux
molécules de formule brute identique soient considérée comme isomères :
exemple CH3-O-CH3 et CH3-CH2-OH. Réponses a et c.
2. La masse molaire de deux isomères est identique. Vrai.
La masse volumique de deux isomères est différente. Vrai.
éthanol : 0,789 g / L ; éther méthylique : 1,91 g / L.
La température de fusion des isomères est identique. Faux.
3. Deux isomères ne sont jamais superposables. Vrai.
Deux isomères représentent toujours des molécules différentes. Vrai.
Il existe trois classe d'isomères. Faux.
Type d'isomérie : isomères de chaîne, de position, de fonction, géométriques, optiques.
4. 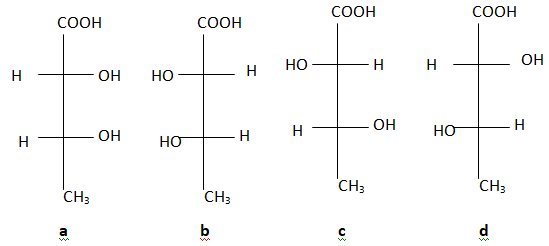
a et b sont énantiomères. Vrai.
a et c sont énantiomères. Faux. ( diastéréoisomères).
c et d sont images l'un de l'autre dans un miroir. Vrai.
c et d sont diastéréoisomères. Faux.
5.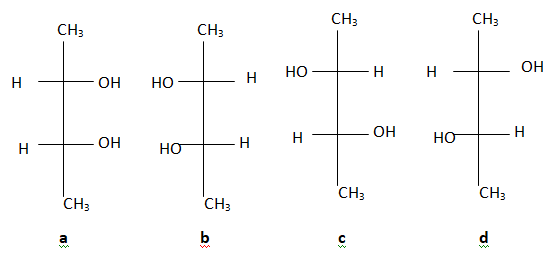
a et b sont optiquement actives. Faux. il existe un plan de symétrie.
c et d sont optiquement actives. Faux. il existe un centre de symétrie.
L'origine d'une activité optique est l'absence de plan de symétrie dans la molécule. Faux.
La présence d'un atome de carbone asymétrique permet l'activité optique d'une molécule. Vrai.
6. 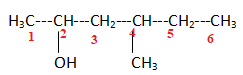
4-méthylhexan-2-ol. Réponse a.
7 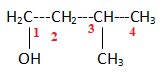
3-méthylbutan-1-ol. Réponse d.
8.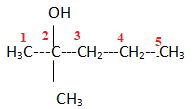 2-méthylpentan-2-ol. Réponse c.
9.
2-méthylpentan-2-ol. Réponse c.
9. 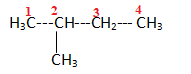
alcane, 2-méthylbutane. Réponses b et d.
10.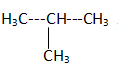
méthylpropane. Réponse c.
11. 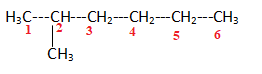
2-méthylhexane. Réponse b.
12. Le groupe fonctionnel carboxyle confère à la molécule un caractère acide. Vrai.
L'acide formique peut s'accumuler dans les muscles après un effort intense et provoquer des courbures. Faux. ( acide lactique).
l'acide éthanoïque est l'acide le plus simple car in contient un seul carbone. Faux.
13. 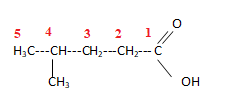 acide 4-méthylpentanoïque. Réponse b.
acide 4-méthylpentanoïque. Réponse b.
14. 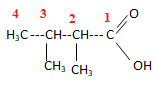 acide 2,3-diméthylbutanoïque. Réponse a.
acide 2,3-diméthylbutanoïque. Réponse a.
15. un échantillon de méthane de masse m = 0,45 g.
Masse molaire du méthane : 12+4 = 16 g/mol.
n = 0,45 / 16 = 0,028 mol de méthane.
0,028 x6,02 1023 =1,7 1022 molécules de méthane ou d'atomes de carbone.
1,7 1022 x4 =6,8 1022 atomes d'hydrogène.
16. AZXq.
A : nombre de nucléons ; Z : numéro atomique ; q : charge.
Donner le nombre de neutrons, électrons et protons des atomes ou ions suivants :
5928Ni : 59-28 =31 neutrons ; 28 protons et 28 électrons.
5626Fe3+: 56-26 =30 neutrons ; 286 protons et 26-3=25 électrons.
4020Ca2+ : 40-20 = 20 neutrons ; 20 protons et 20-2 = 18 électrons.
7934Se2- :79-34=45 neutrons ; 34 protons et 34+2 = 36 électrons.
Calculer en u.m.a la masse du noyau suivant :
147N.
14 u.