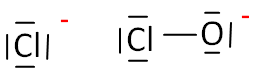Chimie,
Concours interne ingénieur industrie et des mines 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Exercice
1 : l’eau de Javel
Dans ce problème on s’intéresse aux propriétés des constituants de
l’eau de javel. L’eau de Javel contient un mélange équimolaire de
chlorure de sodium (Na+ + Cℓ–) et d’hypochlorite
de sodium (Na+ + CℓO–) en solution aqueuse.
1. Donner le
nombre d’électrons de valence de l’atome de chlore (Z=17) dans son état
fondamental.
1s2 2s2 2p6 3s2 3p5.
; 7 électrons de valence.
2. Donner une
représentation de Lewis des deux anions présents dans l’eau de Javel.
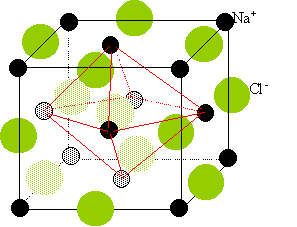
3.Le chlorure de
sodium solide NaCl cristallise à l’état solide. Dans cette structure
les anions décrivent un réseau cubique à faces centrées. Les cations
occupent les sites octaédriques de cette structure cfc. Sa masse
volumique vaut r
= 2,16 103 kg.m-3.
a. Faire un schéma
de la maille cristalline.
b.
Exprimer puis calculer le paramètre de maille a en fonction de la masse
volumique.
La maille
compte en propre 4 motifs NaCl.
Masse de la maille : 4 * masse molaire NaCl (kg/mol) / nombre d'Avogadro.
masse = 4*58,5 10-3 / 6,023 1023
= 3,88 10-25 kg.
Volume de la maille a3. (en m3).
Masse volumique (kg/m3
)=2 160 = 3,88 10-25 / a3.
a3 = 3,88 10-25 / 2 163 =0,1796 10-27 m3.
a = 5,64 10-10 m.
4. Soit
une eau de Javel telle que [Cl–] = [ClO–] = 1,0.
10-2 mol.L-1.
a. A l’aide des
données des pKa, indiquer, parmi ces deux ions, l’espèce responsable
des propriétés acido-basiques de l’eau de Javel. S’agit-il de
propriétés acides ou basiques ? Justifier.
pKa(HClO / ClO-) = 7,4.
L'ion hypochlorite est responsable des propriétés acido-basiques.
Il s'agit de propriété basique.
b. Ecrire
l’équation de la réaction de cette espèce avec l’eau et donner sa
constante d’équilibre.
ClO-aq + H2O(l) = HClO aq + HO-aq.
K = [HClO aq] [HO-aq] / [ClO-aq] = [HClO aq] [HO-aq] [H3O+aq]/ ( [H3O+aq] [ClO-aq] )= Ke / Ka =10-14 / 10-7,4
=2,5 10-7.
c. Calculer
le pH de la solution.
K ~ [HO-aq]2 / [ClO–] ; [HO-aq]2 = 2,5 10-7 x0,01
= 2,5 10-9 ; [HO-aq] =5,0 10-5 mol / L.
[H3O+aq] = 10-14
/ (5,0 10-5) =2 10-10 mol / L ; pH = 9,7.
5. Soit
un bécher contenant :
- V0 = 10 mL d’une solution S d’eau de Javel de
concentration C0 en ClO–, que l’on cherche à
déterminer.
- V1 = 50 mL d’une solution d’arsénite de sodium (Na+
+ AsO2-) de concentration C1 = 4,5.10-2
mol.L-1
- On fixe le pH à une valeur de 8,5.
a. A l’aide des
données, préciser la nature de la réaction qui a lieu entre l’ion ClO–
présent dans l’eau de Javel et l’ion arsénite. Ecrire l’équation-bilan
de cette réaction.
b. Calculer
sa constante d’équilibre.
E°( ClO- /Cl-)=E°1=1,72 V. E°( AsO43- /AsO2-)=E°2=1,01
V.
Réduction de l'oxydant ClO- +H2O+2e- --> Cl- +2HO-.
E1=E°1+0,03 log([ClO-] /([Cl- ] [HO-]2).
Oxydation du réducteur : AsO2- +4HO- --> AsO43- + 2e-+2H2O.
E2=E°2+0,03 log([AsO43-] /([AsO2- ] [HO-]4)).
AsO2- +2HO- + ClO---> AsO43- + H2O+ Cl-.
K = [AsO43-] [Cl- ] / ([AsO2- ] [ClO-][HO-]2)
E1=E2 ; E°1+0,03 log([ClO-] /([Cl- ] [HO-]2)=E°2+0,03 log([AsO43-] /([AsO2- ] [HO-]4)).
E°1- E°2=0,03 log K =1,72-1,01 = 0,71 ; log K =23,7 ; K = 4,6 1023.
c. L’ion arsénite
en excès est ensuite dosé par une solution de diiode de concentration C2
= 1,0.10-2 mol.L-1. Ecrire la réaction de ce
dosage. On admettra que cette réaction est totale à pH=8,5.
E°(I2/I-)=E°3=0,62 V
AsO2- +4HO- --> AsO43- + 2e-+2H2O.
I2+2e- --> 2 I-.
AsO2- +4HO- +I2--> AsO43- + 2I-+2H2O.
d. Sachant que le
volume de diiode versé à l’équivalence est égal à V2 = 16 mL,
exprimer la quantité nr d’ions arsénite restant dans le
mélange à l’issue de la réaction avec l’eau de Javel
n(I2 ) = C2V2 ; n(AsO2-) excès = n(I2 ) = C2V2 =0,010 x16 = 0,16 mmol.
e. En déduire C0.
n(AsO2-) initial =V1C1 =50 x0,045 =2,25 mmol.
n(AsO2-) réagi =n(ClO-)=2,25 -0,16 =2,09 mmol.
V0 C0 =10 C0 =2,09 ; C0 = 0,209 ~0,21 mol / L.
f. Proposer une
méthode permettant de repérer l’équivalence.
Avant l'équivalence, le diiode est en défaut
Après l'équivalence, le diiode est en excés : en présence d'empois d'amidon, le diiode donne une couleur violette
|
...
|
....
|
Exercice 2 préparation du dihydrogène.
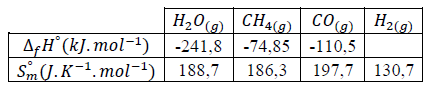
On donne, à 298K, les enthalpies standard de formation et les entropies
molaires standard des constituants suivants :
Un mode de préparation industrielle du dihydrogène met en jeu la
réaction en phase gazeuse, d’équation suivante : 𝐶𝐻4+𝐻2𝑂=𝐶𝑂+3𝐻2
La réaction se déroule sous une pression totale constante, P = 10 bar,
et à une température constante, T = 800 °C = 1073 K.
L’enthalpie standard de réaction et l’entropie standard de réaction
seront supposées indépendantes de la température.
1. Exprimer
l’enthalpie standard de la réaction en fonction des données ci-dessus.
La calculer numériquement.
DHr =DHf (CO) +3DHf (H2)-DHf (H2O)-DHf (CH4)=-110,5+241,8+74,85=206,15 kJ/mol.
2. Exprimer
l’entropie standard de la réaction en fonction des données ci-dessus.
La calculer numériquement
.DSr =Sm (CO) +3Sm(H2)-Sm (H2O)-Sm (CH4)=197,7+3x130,7-186,3-188,7=214,8 J/mol/ K.
3. Exprimer la
constante d’équilibre en fonction des grandeurs des questions 1 et 2
puis la calculer à 800°C.
DG =DHr -T DSr =206,15 103 -(800+273) x214,8 =-2,43 104 J / mol.
DG =-RT ln(K) ; ln(K ) = 2,43 104 /(8,31x 1073)=2,73 : K =15,3.
4. Exprimer la
constante d’équilibre en fonction des pressions partielles des
constituants et de P°.
K = PCO PH23 / (PCH4 PH2OP°2).
Initialement, le système ne contient que 10 moles de méthane et 10
moles d’eau à 800 °C et 10 bars.
5. Déterminer la
composition du système à l’équilibre.
|
avancement (mol)
|
CH4
|
H2O
|
CO
|
3H2
|
initial
|
0
|
10
|
10
|
0
|
0
|
fin
|
x
|
10-x
|
10-x
|
x
|
3x
|
3,62
|
6,38
|
6,38
|
3,62
|
10,86
|
N =20+2x
PCH4 =PH2O= P(10-x) / (20+2x).
PCO = P x /(20+2x) ; PH2 = 3P x /(20+2x) ;
K =27(P/P°)2x4 / [(10-x)2(20+2x)2]
6. Quel volume de
dihydrogène obtient-on à 800°C et sous 10 bars ?
15,3 =27 *100 x4 / [(10-x)2(20+2x)2].
15,3*4*(10-x)2(10+x)2=2700 x4.
(100-x2)2 =44,1 x4 ; 100-x2=6,64 x2 ; x2=100 / 7,64 ; x =3,62 mol.
3x =10,86 mol.
V = nRT / P =10,86 x 8,31 x1073 /(106)=0,096 m3.
|
ane.
|
|
|