Physique
chimie.
Concours ITRF adjoint technique de recherche et de formation 2023
(Lyon).
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
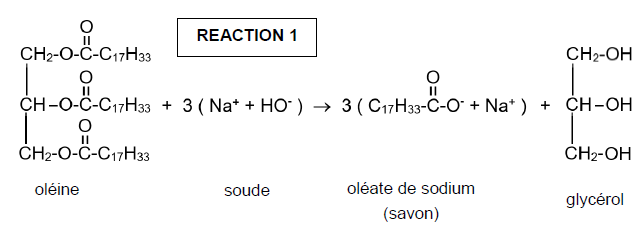
Synthèse d'un savon.
On donne la réaction suivante :

Q1. Donner le
nom de cette réaction et ces caractéristiques.
La saponification est lente et totale.
Q2. Donner les
fonctions chimiques du réactif ainsi que des produits obtenus.
Le réactif est un ester.
Produits : carboxylate de sodium et alcool.
On considérera par la suite que l'huile d'olive est uniquement
constituée de trioléate de glycérol et
que l'un des produits de réaction obtenu est le glycérol.
Q3. Ecrire
l'équation -bilan de réaction.
On donne le protocole suivant :
1. Dans un ballon de 250 mL,
verser les 15.0 g d'huile d'olive pré-pesée.
2. Ajouter 25 mL d'une solution
d'hydroxyde de sodium à 25% et 10 mL d'éthanol.
3. Chauffer le mélange à reflux
pendant environ 45 minutes.
Q4.
Proposer un montage de synthèse et légender-le.
Chauffage
à reflux : 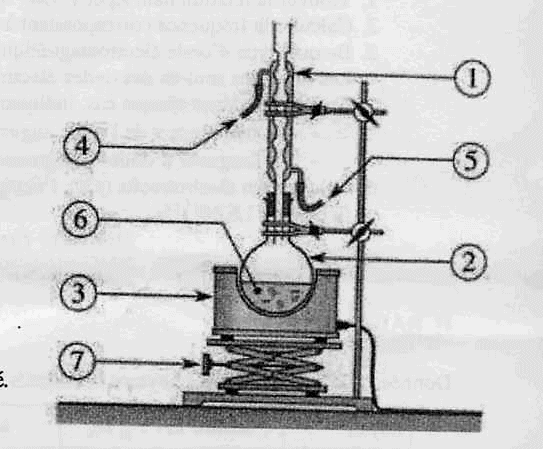
1 : réfrigérant à eau ; 2 : ballon ; 3 : chauffe ballon
; 4 : sortie de l'eau ; 5 : entrée de l'eau ; 6 : mélange réactionnel (
huile + solution de soude alcoolique ) ; 7 : élévateur à croisillons.
Q5. Calculer les quantités de
matière des réactifs. Quel est le réactif limitant, le réactif en excès
?
15,0 g d'huile d'olive ;
M(oléine) = 884 g / mol).
n = 15,0 / 884 =1,02 10-2 ~1,7 10-2 mol
25 mL d’hydroxyde de sodium (soude) à 25 %. M(NaOH) = 40 g /mol.
25 g de soude dans 100 mL d'eau ou 6,25 g de soude dans 25 mL d'eau ;
n' = 6,25 / 40 ~0,16 mol.
n' / 3 = 5,2 10-2 > 1,7 10-2. La soude est en
excès.
4.Verser le milieu
réactionnel dans 150 mL de solution saturée en chlorure de sodium en
agitant
vigoureusement.
Q7. Proposer un
protocole détaillé permettant de préparer 200 mL d'une solution de
chlorure de sodium saturée.
A 20°C on peut dissoudre au maximum 360 g de NaCl par litre d'eau soit
72 g dans 200 mL.
Peser 72 g de chlorure de sodium ; verser dans un erlenmeyer contenant
200 mL d'eau et agiter.
5. Rincer le ballon
avec 50 mL de solution saturée.
6.Laisser reposer
quelques minutes et filtrer sous vide sur Büchner.
Q8. Que peut-on
utiliser à la place du Büchner ?
Un entonnoir avec un disque en verre fritté.
7.Laver le savon
avec sur filtre avec 25 mL d'eau froide.
8. Dans une boîte
de pétri préalablement tarée, on collecte le solide.
9.On place le
produit à l'étuve pendant 15 minutes. On obtient 12.0 g de savon de
masse molaire
M=304 g/mol.
Q9. Pourquoi
place-t-on le produit à l'étuve ?
Eliminer les traces d'eau.
Q10.Quel est le
rôle de l'éthanol introduit dans le milieu réactionnel ?
Les
réactifs et les produits sont tous très solubles dans l'étahnol (
solvant).
Q11. Expliquer
l'utilisation de l'eau salée lors de la préparation du savon.
Le savon est trés peu soluble dans l'eau salée, il précipite.
Q12. Quel est le
rôle du rinçage à l'eau froide ?
Eliminer les traces de soude, réactif en excès.
Q13. En vous aidant
d'un tableau d'avancement, calculer le rendement de la réaction.
|
avancement
|
huile
d'olive
|
+soude
|
-->
oléate de sodium
|
+
glycérol
|
initial
|
0
|
0,017
|
excès
|
0
|
0
|
fin
|
xfin
|
0
|
3xfin = 3 x0,017
=0,051
|
0,017
|
M(oléate de sodium) =304 g / mol ; masse théorique = 0,051 x 304=15,5 g.
Rendement 12 / 15,5 =0,77 (77 %).
Q14. Dans les
annexes fournies, les pictogrammes de sécurité relatifs aux produits
utilisés lors de la synthèse du savon vous ont été fournis. Donner la
signification de ces pictogrammes.

|
...
|
....
|
Exercice II : Etude de la solution de soude
On souhaite déterminer précisément la concentration molaire de la
solution d'hydroxyde de sodium à 25% utilisée lors de la synthèse.
Q15. En vous aidant
des documents en annexe proposer un protocole de dosage.
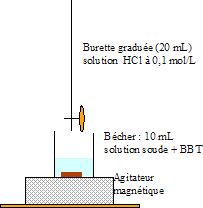
.Remplir
la burette avec la solution titrante HCl.
Prélever 10 mL de solution de
soude à l'aide d'une pipette jaugée,
verser dans le becher et ajouter quelques gouttes de BBT. Mettre en
route l'agitation.
Ajouter goutte à goutte la
solution titrante jusquau changement de
couleur de l'indicateur coloré.
Q16. Quelle est
l'espèce titrée, l'espèce titrante ?
Acide chlorhydrique, espèce titrante ; soude, espèce titrée.
Q.17 Quel est le
nom de ce dosage ?
Titrage acide fort base forte.
Q19. Quel indicateur coloré
allez-vous utiliser pour ce dosage ? Pourquoi ?
BBT : la zone de virage de l'indicateur coloré doit contenir le pH du
point équivalent ( 7 dans ce cas).
Q20. Pour un dosage
acide faible /base forte quel indicateur coloré allez-vous choisir ? Et
pour un
dosage base faible/acide fort ?
dosage acide faible base forte :
pH équi >7 car la solution contient la base faible A2- à
l'équivalence.
indicateur coloré : phénolphtaléine
dosage base faible acide fort ;:
pH équi < 7 car la solution contient l'acide faible AH
à
l'équivalence.
indicateur coloré : hélianthine.
La concentration molaire d'acide chlorhydrique utilisée pour ce dosage
est 1,0.10-1 mol/L. Pour effectuer ce dosage, on prévoit de
diluer d'un facteur 50 la solution d'hydroxyde de sodium à 25% pour
obtenir 100 mL de solution diluée.
Q21. Est-ce
nécessaire ? Si oui, comment allez-vous préparer cette solution diluée ?
La solution d'hydroxyde de sodium étant trop concentrée, on doit la
diluer.
Prélever 100 / 50 = 2,0 mL de solution mère à l'aide d'une pipette
jaugée. Verser dans une fiole jaugée de 100 mL contenant un tiers d'eau
distillée.
Compléter jusqu'au trait de jauge à l'aide d'eau distillée et agiter
pour rendre homogène.
Le volume à l'équivalence obtenu expérimentalement est 16.7 mL.
Q22. Déterminer la
concentration molaire de la solution d'hydroxyde de sodium à 25% ?
A l'équivalence Ca Véqui = VB CB
; CB
=Ca
Véqui = VB =0,10 x 16,7 / 100 =1,67 10-2 mol
/ L.
Tenir compte de la dilution : 50 x 1,67 10-2 ~0,84 mol / L.
Exercice III :
L’oxydo-réduction
Q23. Donner la
signification de Cathode.
Electrode où se déroule une réduction.
Q24. Donner la
signification de l’Anode.
Electrode où se déroule une oxydation.
Q25. Donner la
signification de l’Electrode.
Tige métallique conductrice.

Q26. Sur le montage
ci-dessus, nommer les numéros 1,2,3 et 4.
Q27. Expliquer la
différence (principe et avantage/inconvénient) entre la pile Volta et
la pile Daniell.
Une
pile Volta est
réalisée en empilant successivement des « cellules élémentaires ».
Chaque cellule élémentaire est constituée d’une rondelle de cuivre,
d’une rondelle de matériau absorbant imbibé de solution aqueuse
contenant des ions et d’une rondelle de zinc.
Le
gaz qui se forme lors de l’utilisation de la pile Volta empêche la
production d’un courant constant au cours du temps, nécessaire pour
l’alimentation de certains appareils électriques, comme le télégraphe.
Progressivement, la pile Daniell remplace les piles basées sur le
principe de Volta. Elles peuvent être associées en série pour augmenter
la tension globale délivrée.
Q28. Dans la pile
ci-dessous, écrire les demi-réactions et réactions total de la pile.

Q29. Parmi les deux
couples Cu2+/Cu et Zn2+/Zn lequel est l’oxydant
et le réducteur.
Le réducteur Zn s'oxyde et libère des électrons ; l'ion cuivre,
l'oxydant se réduit.
Q30. Equilibrer les
2 demi-équations et l’équation bilan suivante en milieu acide :
2 fois {Cr2O7
2- +14H+ +6e--->2 Cr3++7H2O
}
3 fois {C2H6O
+H2O-->
C2H4O2+ 4H+
+4e-}.
Ajouter et simplifier :
2Cr2O7
2- +28H+ +12e- +3C2H6O
+3H2O-->4Cr3++14H2O
+
3C2H4O2+ 12H+
+12e-.
2Cr2O7
2- +16H+ +3C2H6O
-->
4Cr3++11H2O +
3C2H4O2
Exercice IV : La
spectrophotométrie UV
Q31. Décrire
brièvement le principe de la spectrophotométrie..
Le
principe de la spectrophotométrie repose sur la mesure de l'absorbance
A de l'espèce X en solution dans un solvant Y. cette grandeur est le
résultat de la comparaison de deux intensités lumineuses : celle d'une
radiation monochromatique ayant traversée une cuve transparente
contenant le solvant Y, et celle de la même radiation élmergent de la
même cuve contenant la solution de l'espèce X dans le solvant Y.
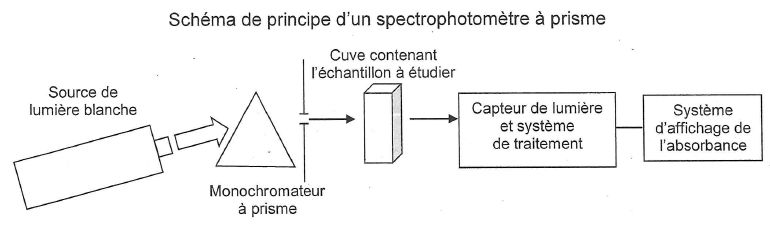
Q32. Quelle loi
utilise-t-on en spectroscopie UV/Visible ? Donner cette loi avec les
unités.
A= log (I0/I) = elc ( A est l'absorbance ou densité
optique)
Cette loi est vérifiée lorsque la solution est de concentration
inférieure à : c < 0,1 mol.L-1.
e (L mol-1 cm-1) est une caractéristique de la molécule.
Plus e sera grand, plus la solution absorbe.
l est
l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L).
Q33. Qu’est-ce que la transmittance
?
La transmitance
T est définie comme le rapport de l'intensité
transmise à l'intensité incidente.
T = I / I0 ;
log T= -A.
Q34. Quelle est la
gamme de longueur d’onde pour le domaine de l’UV et du Visible ?
UV
: 100 à 400 nm ; visible 400 à 800 nm.
Q35. Quel type de
dosage fait-on ?
Dosage spectrophotométrique.
Q36. Peut-on le
faire à toutes les concentrations ?
Non, les concentrations doivent être assez faibles, inférieures à 0,1
mol / L.
Q37. Comment
fait-on le zéro de l’appareil ?
Mesure de l'absorbance avec le solvant seul.
Q38. Existe-t-il
une différence de matériau entre une cuve utilisée pour l’UV et une
cuve utilisée pour le visible ? Pourquoi ?
Les cuves doivent être transparente à la lumière qui les traverse.
Cuve en polystyrène optique ou en verre : plage de lumière 350 à 800 nm.
Cuve en quartz : mesure entre 200 et 300 nm.
Exercice V : Hygiène et
Sécurité
Q39. Donner la
signification des pictogrammes suivants :

Q40. Peut-on
stocker au sein de la même armoire des solvants et des produits
organiques comburants ?
Non, certains solvants sont inflammables.
Q41. Donner la
signification de EPI ainsi que 3 exemples.
Equipements de protection individuelle : gant, lunette, blouse.
Q42. Donner la signification de EPC ainsi que 3 exemples.
Equipement de protection collective : Extincteur, Postes de sécurité
microbiologiques.
Sorbonnes pour la protection
contre le risque chimique, pour les produits volatils toxiques par
inhalation
Ventilation
correcte des locaux.
Conteneurs
adaptés pour les produits souillés.
Stockage
réglementaire des produits dangereux.
Signalisations
des zones où sont manipulés des agents biologiques ou des radioéléments.
Q43. Qu’est-ce qu’un produit CMR ?
Cancérigène, mutagène, reprotoxique.
Q44. Etablir les
règles générales de sécurité pour une manipulation de produit toxique
et acide dans un laboratoire de chimie.
Port de gants, blouse, lunettes et travail sous hotte aspirante.
Q45. Qu’est-ce
qu’une FDS ? Donner les principales informations que l’on trouve sur
une FDS.
Fiche de données de sécurité.
Renseignements relatifs aux dangers et conseils concernant les mesures
de précautions à prendre pour assurer sa sécurité.
Q47. Un collègue
ingère un produit toxique, que faites-vous ?
Appelez le numéro d'urgence médicale ( 15 ou 112). Le médecin
régulateur pose des questions pour évaluer l'état médical de la
personne.
Q48. Suite au
retentissement de l’alarme incendie, vous avez évacué le bâtiment, que
faites-vous ensuite ?
Réaliser un recensement et prévenir le coordinateur si un agent manque
à l'appel.
Q49. Dans quel
bidon jetez-vous les produits chimiques suivants ?
Propan-3-one : solvant.Soude : base ; C2H5COOH,
HNO3 , vinaigre: acide ;
Eau oxygénée : oxydant.
Exercice VI : Electricité
On réalise le montage électrique ci-dessous.
Q50. Compléter le
tableau suivant en recopiant les symboles électriques des dipôles
présents dans le schéma électrique et en nommant les dipôles. Quand
cela est possible, préciser le nom de la grandeur physique associée
ainsi que son unité internationale.

Q51. Nommer les 2
appareils qui permettent de mesurer la tension et l’intensité aux
bornes du condensateur. Préciser s’ils se branchent en série ou en
dérivation.
L'ampèremètre monté en série mesure l'intensité.
Le voltmètre monté en dérivation donne la tension.
Q52. Ajouter ces
deux appareils de mesure sur le schéma du montage électrique mis en
introduction.
Q53. Sur ce même
schéma du montage électrique, indiquer le sens de circulation du
courant et des électrons sur le schéma.
Q54. Dans un
premier temps, on bascule l’interrupteur dans la position 1. Expliquer
ce qu’il va se passer.
Le condensateur se charge.
On bascule ensuite l’interrupteur en position 2 et on enregistre les
variations de la tension uC aux bornes du condensateur. On
observe l’oscillogramme ci-dessous :
Q55. Expliquer si
les oscillations observées sont libres ou forcées. Justifier la réponse.
Q56. Préciser la
nature du régime d’oscillation observé.
Interrupteur
en position 2 : circuit RLC sans générateur ; les oscillations sont
libres et amorties ( diminution de l'amplitude).
Q57. Relever graphiquement la valeur
de la tension E du générateur.
Q58. Mesurer
graphiquement la pseudo-période T des oscillations.

Q59. Sachant que la
fréquence des oscillations vaut : f =1 / (6,28 (LC)½) et que
C = 2,0 10-6 F, calculer la valeur
de l’inductance de la bobine L.
f = 1 / T = 1 / 0,004=250 Hz ; LC = 1 / (6,28 f)2=1 /(250x6,28)2=4,06 10-7.
L = 4,06 10-7 / (2 10-6)=0,20 H.
Exercice VII : Conversion
Q60. Convertir dans l’unité donnée. Donner les réponses en notation scientifique.
350 cm3 =0,350 L = 3,5 10-1 L.
0,013 A = 13 mA =1,3 101 mA.
455 nm = 455 10-9 m = 455 10-3 µm =4,55 10-1 µm.
3,7 kW = 3,7 103 W.
23,9 V = 23,9 10-3 kV = 2,39 10-2 kV.
58,7 kg = 58,7 106 mg =5,87 107 mg.
5,1 km / h = 5,1 / 3,6 m/s =1,4 m/s.
85 kWh = 85x 3,6 106 J = 3,06 108 J.
VIII.I Etude des lois de Snell-Descartes
La glycérine est un liquide transparent et légèrement visqueux,
utilisée dans les cosmétiques pour ses effets hydratants et
antibactériens.
Un rayon lumineux, se propageant dans l’air, arrive en I sur un demi-cylindre rempli de glycérine, comme le montre le schéma .
Données : indice de réfraction de l’air : n1 = 1,00 ;
indice de réfraction de la glycérine : n2 = 1,46

Q61. A l’aide du schéma ci-contre : Déterminer la valeur de l’angle d’incidence i1.
i1 = 50°.
Q62. Soit i2,
l’angle de réfraction observé dans la glycérine. Ecrire la loi de
Snell-Descartes pour la réfraction, en respectant les notations de
l’énoncé et calculer i2.
n1 sin i1 = n2 sin i2.
sin i2 = 1 x sin 50 / 1,46 =0,525 ; i2 =31,6°.
Q63. Tracer le rayon réfracté sur le schéma.
VIII.2 Lentille convergente
L’objectif de cet exercice est de construire l’image d’un objet AB à
travers une lentille convergente, de distance focale f’ = 4,0 cm.
Directement sur le schéma ci-dessous :
Q62. Placer les points remarquables de la lentille : O (centre optique), F (foyer principal objet) et F’ (foyer principal image).
Q63.En utilisant
les trois propriétés des rayons lumineux issus de B et traversant la
lentille convergente, construire l’image A’B’.
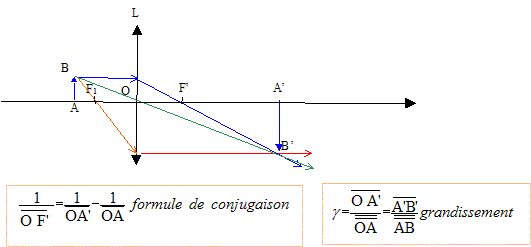
Q64. Comment différencier une lentille convergente d’une lentille divergente ?
Lentille convergente : le centre est plus épais que les bords.
Lentille divergente : les bords sont plus épais que le centre.
Exercice IX : Gaz parfait
Donner la définition des transformations suivantes :
Q65. Qu’est-ce qu’une transformation isobare ?
La pression reste constante.
Q66. Qu’est-ce qu’une transformation isotherme ?
La température reste constante.
Q67. Qu’est-ce qu’une transformation isochore ?
Le volume reste constant.
Q68. Donner la loi des gaz parfaits ainsi que la signification et l’unité de chaque terme.
PV = nRT.
P : pression ( pascal) ; V : volume en m3 ; n : nombre de moles ; T température en kelvin ; R =8,314 J K-1mol-1.
Q69. Nous élevons la température de 30°C d’un volume de gaz parfait de 15 L, calculer l’augmentation de pression.
P1 V = n RT1 ; P2 V = n RT2 ; P1 / T1 = P2 / T2 =nR / V.
P2-P1 =P1(T2-T1)/T1= nR / V (T2-T1)=8,314 /0,015 n x30 =1,66 104 n.
Q70. Donner la valeur du volume molaire d’un gaz parfait dans les conditions normales de température et de pression.
22,4 L mol-1.
|
|












