Chlore
libre, les chloramines, traceur radioactif . Bts Biotechnologies 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Chlore libre ( 11 points)
A Structure de la molécule d'acide hypochloreux.
1. Déterminer la configuration électronique de l'atome de chlore Z = 17.
1s2 2s2 2p6 3s2 3p5.
2. Justifier le schéma de Lewis de l'atome de chlore.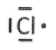
7 électrons de valence répartis en 3 doublets et un électron seul.
3. Donner le schéma de Lewis de la molécule d'acide hypochloreux HClO.
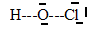 4. Déterminer la géométrie de l'acide hypochloreux en s'appuyant sur la méthode VSEPR.
4. Déterminer la géométrie de l'acide hypochloreux en s'appuyant sur la méthode VSEPR.
2 paires d'électrons non liants et 2 paires d'électrons liants : type AX 2E 2, en forme de V.
5. Justifier la présence d'une charge partielle négative sur l'atome d'oxygène et positive sur l'atome de chlore.
L'atome d'oxygène est plus électronégatif que l'atome de chlore.
B. Réaction de l'acide hypochloreux avec l'eau.
6. Ecrire l'équation de la réaction modélisant la transformation chimique entre l'aciide hypochloreux et l'eau.
HClO aq + H2O(l) = ClO-aq + H3O+aq.
7. Exprimer la constante Ka.
Ka = [H3O+aq] [ClO-aq] / [HClO aq] = 10-7,5.
8. Indiquer le pourcentage de forme acide HClO à pH = 7,5.
[ClO-aq] =[HClO aq] = 50 %.
Le pH idéal de l'eau d'une piscine se situe entre 7,2 et 7,4. La sueur
des baigneurs, la production de mucus, fait que le pH augmente
légèrement. Le pH est passé à 8,0.
9. Donner le diagramme de prédominance du couple HClO / ClO-.
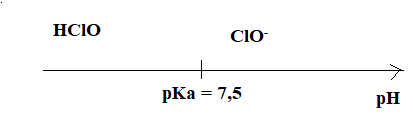
10. Expliquer pourquoi une augmentation du pH de l'eau pose problème quant à la prolifération des micro-organismes.
A pH supérieur à 7,5, ClO- est majoritaire. Seule la forme HClO peut combattre virus et bactéries.
On préfère remplacer HClO par l'acide hypobromeux HBr qui possède des propriétés analogues.
11. Déterminer le pourcentage d'acide hypobromeux dans l'eau à pH = 8.
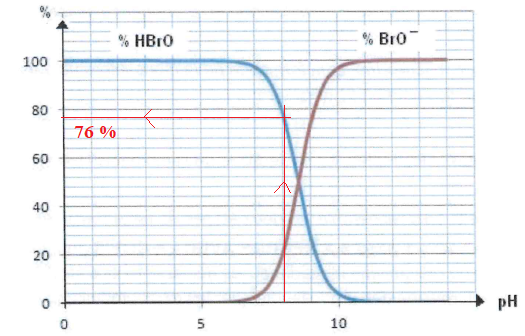 12-
12- Le pourcentage d'acide HClO à pH =8 est de 24 %. Justifier l'utilisation de HBrO.
A pH = 8, HBrO est plus performant que HClO pour détruire bactéries et virus.
Les chloramines (12 points).
Formation des chloramines.
1- Préciser la nature électrophile ou nucléophile de l'ammoniac.
Présence d'un doublet libre sur l'azote: donc nature nucléophile de l'ammoniac.
2- Compléter :
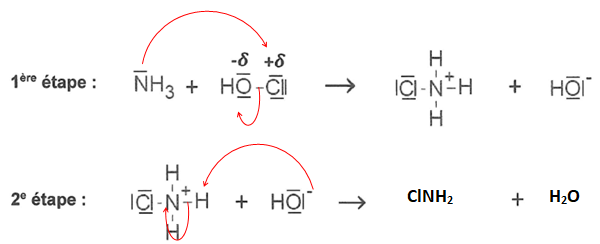 3. Quel est le type de réaction de la seconde étape ?
3. Quel est le type de réaction de la seconde étape ?
Réaction de type acide base.
Huiles essentielles pour masquer l'odeur des chloramines.
4. Entourer puis nommer la fonction présente dans la molécule de carvone.
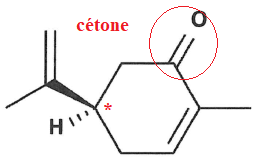
5-Indiquer la position du carbone asymétrique après l'avoir défini.
Carbone asymétrique : atome de crbone lié à 4 atomes ou groupes d'atomes différents.
6. Justifier que cette représentation correspond à l'isomère R.
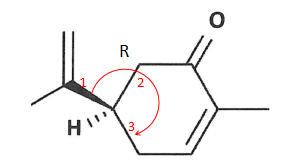
7. Indiquer la signifcation du symbole (-) dans la R(-) carvone.
Lévogyre, qui dévie vers la gauche ou dans le sens inverse des aiguilles d'une montre le plan de la lumière polarisée.
8. Représenter l'autre énantiomère et le nommer.
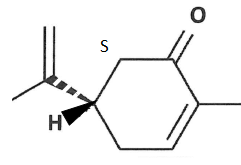 9.
9. Citer une méthode physique permettant de distinguer deux énantiomères.
Mesure du pouvoir rotatoire à l'aide d'un polarimètre.
|
...
|
....
|
Le chlore 36 : un traceur radioactif.
C'est un émetteur ß- ; sa demi-vie est de 3,01 105 ans.
Dans les eaux de surfaces le chlore 36 est renouvelé et la teneur en chlore 36 est constante.
Dans les eaux souterraines anciennes la teneur en chlore 36 diminue selon la loi de décroissance radioactive.
1 Donner la composition du noyau 3617Cl.
17 protons et 36-17 = 19 neutrons.
2. Nommer la particule émise et écrire son symbole.
électron 0-1e.
3- Ecrire l'équation modélisant cette transformation.
3617Cl --> 3618Ar +0-1e.
Conservation de la charge 17 = 18-1 ; conservation du nombre de nucléons : 36 = 36+0.
L'énergie libérée lors de la désintégration d'un noyau de chlore 36 est
E = 0,71 MeV. Cette énergie est émise sous forme d'un rayonnement
électromagnétique.
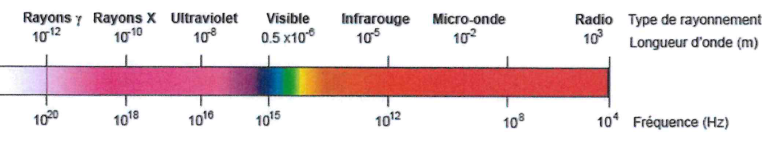
4- Indiquer le domaine du spectre en justifiant.
E = h f ; f = E / h =0,71 106 x1,6 10-19 / (6,63 10-34) =1,7 1020 Hz. Domaine des rayons g.
On souhaite déterminer l'activité radioactive liée au chlore 36 dans
une bouteille d'eau d e volume V = 1 L de concentration massique en ion
chlorure C = 200 mg / L. La proportion de noyaux de chlore 36 est de 1
pour 1,43 1012 noyaux d'ion chlorure.
5- Montrer que n(Cl-) = 5,63 10-3 mol.
masse / masse molaire ( Cl)= 0,200 / 35,5 =5,63 10-3 mol.
6- En déduire que le nombre de noyaux d'ions chlorure est NCl- = 3,39 1021.
5,63 10-3 x 6,02 1023 =3,39 1021.
7. Montrer que le nombre de noyaux de chlore 36 est N =2,40 109.
3,39 1021 /(1,43 1012) =2,40 109.
8. Expliquer ce que représente 1 Becquerel.
1 Bq correspond à une désintégration radioactive par seconde.
La constante radioactive l du chlore 36 vaut 7,30 10-14 s-1.
9. Déterminer l'activité en chlore 36 d'un litre d'eau.
A0= l N =7,30 10-14 x2,40 109 =1,75 10-4 Bq.
L'activité d'un litre d'une eau souterraine est A telle que A = 0,35 A0.
10. Calculer l'âge de l'eau souterraine.
A = A0 exp(-l t) ; 0,35 = exp(-7,30 10-14 t).
ln(0,35) = -7,30 10-14 t ; t = 1,44 1013 s.
1,66 108 jours ou 4,6 105 ans.
|
|
|
|