Acidité
totale d'un vin,
bac Amérique du
nord 2024
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
. |
..
..
......
...
|
1. Etude de l'acide tartrique
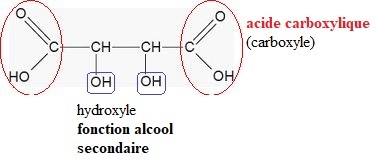
On donne la formule de l'acide tartrique, l'un des acides faibles préesents dans le vin :
Q.1. Reproduire sur votre copie la formule topologique de l'acide tartrique et entourer les groupes caractéristiques.
Q.2. Nommer les familles fonctionnelles correspondantes.
 Le dioxyde de carbone se dissout dans l'eau du vin. Cette dissolution aboutit à la formation d'acide carbonique H2CO3(aq). L'acide carbonique est un diacide faible dont les bases associée sont hydrogénocarbonate HCO3-(aq) et les ions carbonate CO32-(aq).
Le dioxyde de carbone se dissout dans l'eau du vin. Cette dissolution aboutit à la formation d'acide carbonique H2CO3(aq). L'acide carbonique est un diacide faible dont les bases associée sont hydrogénocarbonate HCO3-(aq) et les ions carbonate CO32-(aq).
Cet acide n'entrant pas en compte dans la définition de l'acidité du
vin ; ii est nécessaire de l'éliminer avant le titrage de l'acidité
totale du vin. Le protocole experimental de détermination de l'acidité
totale est donné ci-dessous :
• 1ère étape: protocole d'élimination de l'acide carbonique
On place un volume de 50 mL de vin dans un erlenmeyer relié a une
trompe à vide. On agite sous vide pendant deux ou trois minutes pour
eéliminer l'acide carbonique du vin.
• 2ème étape : protocole de titrage
Dans un erlenmeyer, on place :
- un volume VA de vin dont on a éliminé l'acide carbonique;
- 1 0 ml d'eau distillée ;
- 4 a 5 gouttes d'indicateur coloré.
On ajoute une solution d'hydroxyde de sodium (Na+(aq), HO-(aq)) de concentration connue.
L'équivalence est supposée atteinte lorsque le pH vaut 7,0.
Le pH d'un vin doit être compris entre 2,70 et 3,70.
Q.3. Representer le diagramme de prédominance faisant intervenir les couples
H2CO3(aq) / H2CO3(aq) et H2CO3(aq)) / CO32-(aq).H2CO3(aq).
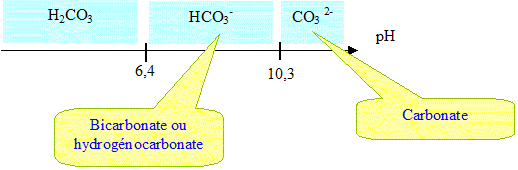
Q.4. En déduire pourquoi il est nécessaire lors d'une première eétape d'éliminer l'acide carbonique du vin.
L'acide carbonique n'est pas pris en compte dans la définition de l'acidité totale du vin.
Q.5. lndiquer en justifiant le nom de l'indicateur colorée à utiliser dans l'étape 2 du protocole.
La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent (pH = 7 dans ce cas).
Bleu de bromothymol.
En France, l'acidite totale AT d'un vin est définie comme équivalente à concentration en masse d'acide sulfurique H2SQ4(aq). La réglementation impose une teneur comprise entre 3,0 et 6,0 g.L- 1.
.
La détermination de l'acidite totale s'effectue par titrage avec une solution d'hydroxyde de sodium (Na+(aq), HO-(aq)) de concentration Cs = 0, 100 mol· L-1, selon l'équation de la réaction support du titrage:
H2SO4(aq) + 2 HO-(aq) --> SO42-(aq) + 2 H2O(l).
Pour pérénniser la qualité de son produit, un viticulteur teste chaque
année son vin et souhaite une production dont l'acidité totale reste
stable a 3,45 g • L- 1.
Le protocole de titrage est réalisé avec VA= 5,0 mL de vin.
Le changement de couleur est observé pour un volume ajouté d'hydroxyde de sodium Vs= 3,5 mL.
Q.6. Déterminer la valeur de l'acidité totale AT du vin analysé.
Quantité de matière d'hydroxyde de sodium : n =Vs Cs = 3,5 x0,1 = 0,35 mmol.
Quantité de matière d'acide sulfurique dans le vin : ½n =0,175 mmol dans 5,0 mL de vin.
0,175 / 5 = 0,035 mol / L.
Masse molaire de l'acide sulfurique : 98 g / mol.
AT = 98 x0,035 ~3,4 g / L.
|
...
|
....
|
Le titrage est ensuite reproduit 10 fois et les résultats sont consignés dans le tableau suivant :
Expérience
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
| AT |
3,41
|
3,38
|
3,52
|
3,45
|
3,43
|
3,45
|
3,44
|
3,41
|
3,42
|
3,40
|
Q.7. Calculer la
valeur moyenne de l'acidité totale AT et !'incertitude-type u(A T) sur
l'acidité totale à partir des résultats précédents.
Ecrire le résultat de la mesure de l'acidité totale moyenne avec un
nombre adapté de chiffres significatifs, u(A T) étant écrit avec un
seul chiffre significatif.
Valeur moyenne : ATmoyen = 3,43 g /L.
Incertitude type u(AT) = s(AT ) n½.
Ecart type s(AT) = 0,0365 ; u(AT) = 0,035 / 10½ =0,01.
AT = 3,43 ±0,01 g/L.
Q.8. Comparer le résultat de cette acidité totale moyenne à la valeur souhaitée par le viticulteur. Conclure.
(AT(mesurée) -AT(référence)) / u(AT) = (3,45-3,43) / 0,01 = 2, les deux valeurs sont compatibles.
En Alsace, l'acidité totale est donnée en équivalent d'acide tartrique,
et non en équivalent d'acide sulfurique. L'acide tartrique H2A est aussi un diacide ; !'équation de la réaction support du titrage
est alors:
H2A(aq) + 2 HO-(aq)---> A 2-(aq) + 2 H2O(l)
Q.9. Choisir la proposition exacte ci-dessous et justifier votre choix.
a. En Alsace, l'acidité totale d'un vin doit être comprise entre 3,0 et 6,0 g·L-1.
b. En Alsace, l'acidité totale d'un vin doit être comprise entre 4,6 et 9,2 g·L-1.
c. En Alsace, l'acidité totale d'un vin doit être comprise entre 1,8 et 3,2 g-L- 1.
.Masse molaire de l'acide tatrique : 150 g /mol.
3,0 / 98 x150 =4,6 ; 6 /98 x150 =9,2 g/ L. ( proposition b).
|
ane.
|
|
|