Pelouse
synthétique, filtre polarisant, échangeur thermique,
bac SPCL Polynésie 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Exercice 1 Pelouse synthétique
.7 points.
Le
polyéthylène est une matière plastique très utilisée, notamment dans la
fabrication de pelouses synthétiques. Il s’obtient par polymérisation
de l’éthène (appelé aussi éthylène), lui-même obtenu par déshydratation
de l’éthanol.
Extraction de l’éthanol du
moût fermenté.
Le broyage des cannes à sucre permet d’obtenir un sirop épais appelé la
mélasse. Après fermentation alcoolique de la mélasse, on obtient un
moût fermenté riche en éthanol, qui est extrait par distillation.
On estime que la concentration en quantité de matière en éthanol dans
le moût fermenté est de 7,5 mol·L-1.
Afin de contrôler la concentration en éthanol dans le moût fermenté,
noté solution S, on réalise une distillation fractionnée. À partir du
distillat, on fabrique par dilution une solution S1. Dans la
suite de l’exercice nous considérerons que la solution S1
correspond à la solution S diluée 50 fois.
1. Légender le
schéma de la distillation et préciser le sens de circulation de l'eau.
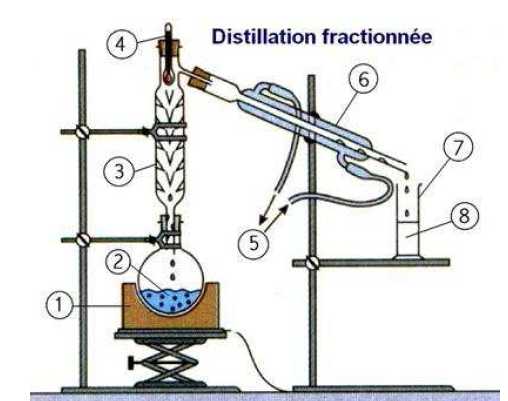
1 : chauffe ballon ; 2 :
mélange à distiller ; 3 : colonne
Vigreux ; 4 : thermomètre ; 5 : entrée de l'eau ; 6 : réfrigérant à eau
; 7 : éprouvette graduée ; 8 : distillat.
L’éthanol
réagit avec les ions dichromate Cr2O72–
en milieu acide, mais cette transformation, quoique totale, est lente :
elle ne peut donc pas être le support d’un titrage.
On réalise alors un dosage en retour de l’éthanol présent dans le
distillat, selon les deux étapes suivantes.
Étape 1 :
les ions dichromate sont introduits en excès dans un volume donné de la
solution S1 pour transformer tout l’éthanol présent en acide
éthanoïque et on laisse le temps nécessaire à la transformation de
s’effectuer.
L’équation chimique de la réaction est :
3C2H5OH + 2Cr2O72- +16H+= 3CH3COOH
+ 4Cr3+ + 11 H2O (1)
Protocole expérimental de l’étape 1
:
-dans un erlenmeyer, on
mélange un volume V1 = 10,0 mL de la solution S1
(distillat dilué), un volume V2 = 10,0 mL d'une solution de
dichromate de potassium de concentration en quantité de matière C2
= 0,50 mol·L-1 et environ 5 mL d'acide sulfurique concentré ;
-on bouche l'erlenmeyer
et on laisse réagir pendant environ 30 minutes ;
-on obtient alors une
solution verdâtre.
2.Montrer que la relation entre la
quantité de matière n1 d'éthanol oxydé et la quantité
dematière d’ions dichromate restant n(Cr2O72-)restant
à la fin de l’étape 1 est :
n(Cr2O72-)restant
= C2V2
– 2 / 3 n1.
n(Cr2O72-)initial
=C2V2
;
n(Cr2O72-)réagissant
=2 / 3 n1.
n(Cr2O72-)restant
= C2V2
– 2 / 3 n1.
Étape
2 : on réalise le dosage par titrage des ions dichromate
restant dans l’erlenmeyer, par les ions Fe2+ apportés par
une solution acidifiée de sel de Mohr. L’équation de la réaction
support du titrage est :
Cr2O72-(aq) + 14 H3O+(aq)
+ 6 Fe2+(aq) → 2 Cr3+(aq) + 21 H2O(l)
+ 6 Fe3+(aq)
La solution de sel de
Mohr a une concentration en quantité de matière C3 = 2,0
mol·L–1 en ions Fe2+. L’équivalence est repérée à
l'aide d'un indicateur de fin de réaction. Le volume de solution de sel
de Mohr nécessaire pour atteindre l'équivalence est VE =
11,8 mL.
3.Réaliser un schéma légendé du
montage permettant d’effectuer le titrage.
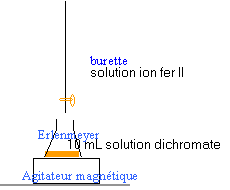
4.Définir
l’équivalence d’un titrage.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques.
5. Écrire, à partir de l'équation de
l'étape 2, la relation qui existe à l’équivalence entre lesquantités de
matière d’ions dichromate et d'ions Fe2+ versés, notés n(Cr2O72-)restant
et n(Fe2+).
n(Cr2O72-)restant
= n(Fe2+)
/ 6.
6.Montrer
que la quantité de matière n1 d’éthanol présente dans 10,0
mL de solution S1s’exprime par la relation suivante :
n1 = 3/2 C2×V2
- 1/4C3×V𝐸.
n(Cr2O72-)restant
= n(Fe2+)
/ 6.
n(Cr2O72-)restant
= C2V2
– 2 / 3 n1.
C2V2
– 2 / 3 n1 = n(Fe2+)
/ 6.
2 / 3 n1 =C2V2
–n(Fe2+) /
6.
n1 =3/2 C2V2
–1/4n(Fe2+)
.
n(Fe2+) =C3×V𝐸.
7.Calculer
la valeur numérique de n1.
n1 = 3/2
x0,50 x10 - 1/4x2x11,8=7,5-5,9=1,6 mmol.
8.En
déduire la valeur de la concentration en quantité de matière C1
en éthanol de lasolution diluée S1.
C1 = n1 / V1 = 1,6 / 10 = 0,16 mol / L.
9.Calculer la valeur de la
concentration en quantité de matière C en éthanol dans le moût
fermenté, appelé solution S.
C = 50 C1 = 50 x0,16 = 8 mol / L.
10.Comparer l’ordre de grandeur de
la valeur de C trouvée avec celle donnée en introduction
La valeur trouvée est en accord avec celle de l'introduction ( 7,5 mol
/ L).
Ecart (8-7,5) / 7,5 =0,067 ( 6,7 %).
11.Identifier deux
sources d'erreur dans la mesure de C.
Erreurs sur les volumes et sur les concentrations.
Production de l’éthène
La production d’éthène se fait par déshydratation de l’éthanol selon
l’équation suivante :
CH3-CH2-OH(g) → CH2=CH2(g)
+ H2O(g)
12. Identifier le
type de réaction chimique à laquelle appartient la réaction de
productionde l’éthène parmi les termes suivants : addition,
élimination, substitution, acide-base,oxydation, réduction.
Elimination de H2O.
La première étape du mécanisme réactionnel de cette réaction chimique
consiste en une réaction entre une molécule d’éthanol et un ion
hydrogène H+ présent dans le milieu réactionnel.
L’équation de cette réaction est donnée.
13. Identifier le
site donneur et le site accepteur d’électrons mis en jeu lors de cette
première étape et représenter, à l’aide d’une flèche courbe, le
mouvement du doublet d’électrons.
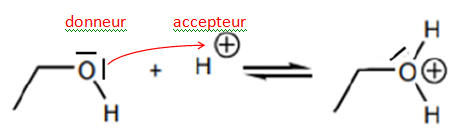
À l’issue de la transformation chimique, un contrôle de pureté est
réalisé par spectroscopie IR. Le spectre IR obtenu est présenté
ci-dessous.
14. Justifier qu’il
ne reste plus d’éthanol à l’aide du spectre IR.
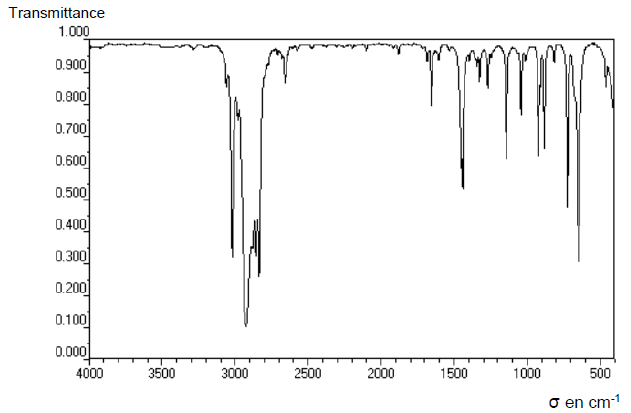
Absence d'une bande large ( OH lié) entre 3200 et 3500 cm-1.
Exercice 2 (6,5
points).
15. Préciser, en
justifiant, si les vagues sont des ondes longitudinales ou
transversales.
La déformation du milieu est perpendiculaire à la direction de
propagation : ondes transversales.
16. Déterminer la
fréquence des vagues le mardi 26 septembre 2023.
Période de la houleT = 7 s ; fréquence f = 1 / T = 1 /7 Hz.
17. Montrer que la
vitesse de propagation des vagues est d’environ 11 m·s-1.
Longueur de la vague L = 80 m ; vitesse = L / T = 80 / 7 ~11 m/s.
Les sportifs pratiquant des sports nautiques comme les surfeurs
protègent leurs yeux à l’aide de lunettes de soleil ayant des
caractéristiques spécifiques.
Afin de comprendre l’intérêt des verres polarisants dans la protection
contre le soleil, une expérience réalisée en laboratoire sur un banc
optique, utilisant un verre de lunette polarisant, est décrite
ci-dessous.
Protocole de
l’expérience :
Au départ, un verre de lunettes de surf est fixé derrière un filtre
polarisant comme sur la photo. Celui-ci impose une polarisation
verticale à la lumière. On l’éclaire avec une lumière non polarisée. On
observe alors une tache de lumière sur l’écran.
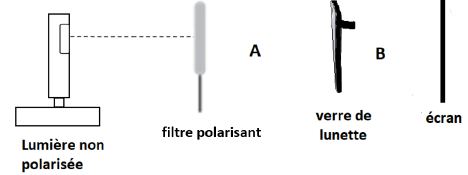
On fait ensuite tourner le filtre polarisant de façon à ne plus avoir
de lumière sur l’écran. L’extinction est obtenue après une rotation du
filtre polarisant d’un angle de 90°.
18. Préciser si la
lumière est polarisée ou non dans la zone A, et si oui indiquer la
direction de la polarisation au début de l’expérience.
Polarisation rectiligne.
19. Justifier
d’après l’expérience que le verre de lunette est bien polarisant et
déterminer la direction de polarisation du verre.
La réflexion de la lumière sur l’eau peut modifier l’état de
polarisation de celle-ci.
En effet, il existe un angle d’incidence particulier, appelé angle de
Brewster, pour lequel la lumière réfléchie est polarisée avec un axe
parallèle à la surface de séparation entre l’air et l’eau.
L’angle d’incidence de Brewster, noté iB, est obtenu dans la
condition où le rayon réfléchi est perpendiculaire au rayon réfracté.
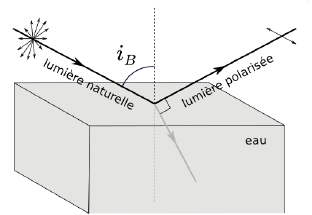
20. La surface de
la mer étant considérée horizontale, expliquer l’intérêt pour le
surfeur que les verres de lunettes soient polarisés verticalement.
Les reflets de surface sont éliminés.
Données :
- indice de réfraction de l’air : na= 1,00
- indice de réfraction de l’eau : ne= 1,33
- pour une surface de séparation air / eau de mer, la valeur de l’angle
de Brewster est de 53,1°.
On se placera dans le cas où la lumière forme un angle d’incidence
proche de celui de l’angle de Brewster.
21. En appliquant
la relation de Snell-Descartes, déterminer la valeur numérique de
l’angle réfracté r et placer sur le document-réponse 3 page 14/14, à
rendre avec la copie, le rayon réfracté et l’angle réfracté r.
na sin i = ne sin r ;
sin r = sin 53 / 1,33 =0,600 ; r ~37 °.
22. Tracer, sur le
document-réponse 3 page 14/14, à rendre avec la copie, le rayon
réfléchi et expliquer en justifiant votre réponse que la condition de
Brewster est bien vérifiée.
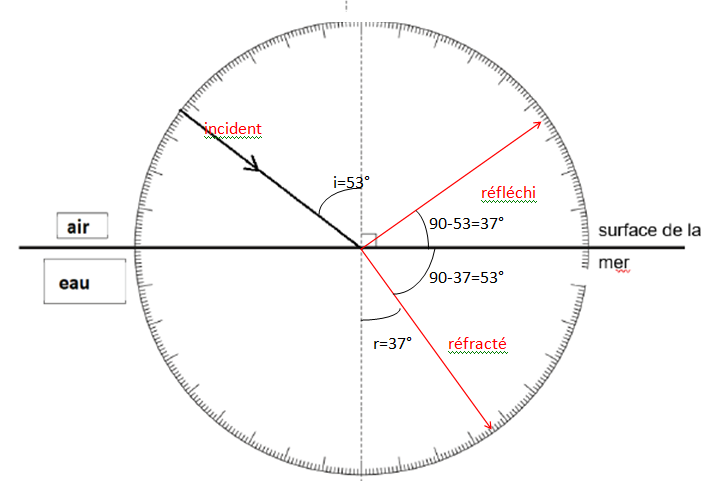
Angle formé entre le rayon réfracté et le rayon réfléchi : 53+37=90°.
Plusieurs groupes d’élèves décident de reproduire en laboratoire la
situation pour vérifier cette condition. Pour cela, un demi-cylindre
rempli d’eau est éclairé avec un angle d’incidence égal à 53° Le
tableau de valeurs obtenues est donné ci-dessous :
Mesure
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
| angle réfracté r(°) |
39
|
37
|
38
|
39
|
40
|
39
|
39
|
23. Déterminer la valeur moyenne de l’angle réfracté et son
écart-type expérimental.
moyenne =(39+37+38+39+40+39+39) / 7 =38,7°.
Ecart type= 0,951.
On rappelle la relation donnant l’incertitude-type sur la valeur
moyenne d’une série de n mesures :
u(moyenne) = (écart type expérimental) / n½ .
24. Calculer la valeur de l’incertitude-type sur la valeur moyenne r de l’angle réfracté.
u(r) = 0,951 / 7½ =0,36.
Dans ces conditions expérimentales, la valeur de référence de l’angle
réfracté, calculée à partir de la valeur théorique de l’angle de
Brewster, est de 36,9°.
25. Discuter de la validité du résultat expérimental, en s’appuyant sur
le rapport suivant :
|moyenne-valeur de référence| / u(moyenne) =(38,7-36,9) / 0,36 =5.
Valeur supérieure à 2, le résultat expérimental n'est pas valide.
|
...
|
....
|
Exercie
3. (6,5 points).
L’énergie
thermique cédée par le data center permettra de produire de l’eau
chaude à une température de 65°C qui sera ensuite envoyée dans un
échangeur thermique afin de maintenir constante la température de l’eau
de la piscine.
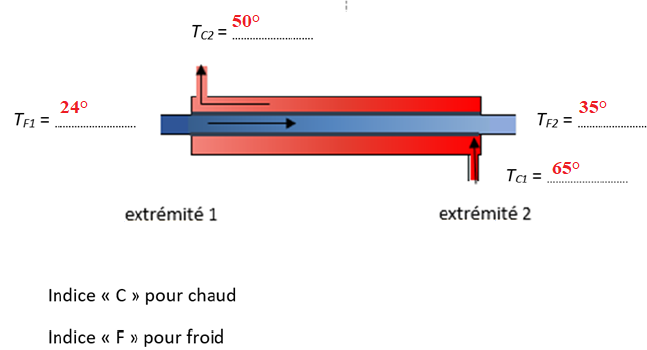
Étude de l’échangeur thermique
On se place dans la situation où l’eau de la piscine entre dans
l’échangeur à une température de 24°C et en ressort à la température de
35°C.
L’eau provenant du data center (à la température de 65°C) sort de l’échangeur thermique à la température de 50°C.
La puissance de cet échange thermique est de 270 kW.
26. En exploitant les données correspondant à la situation étudiée, indiquer sur le schéma les valeurs des températures TF1, TF2 , TC1 et TC2.
27. Citer le mode de transfert thermique permettant l’échange d’énergie thermique à travers la paroi de l’échangeur thermique.
Conduction.
28. D’après les valeurs de conductivité thermique, identifier, en justifiant, le matériau à privilégier pour l’échangeur.
La conductivité thermique de l'aluminium ( l = 237 W m-1 K-1) est supérieure à celle de l'acier et du titane.
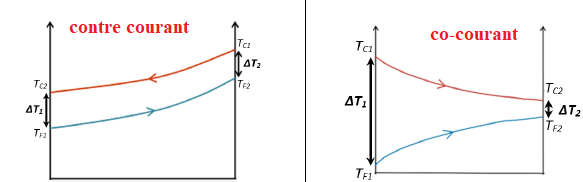
Les fluides circulent à contre-courant dans l’échangeur thermique.
29. Citer le nom de
l’autre sens de circulation possible. Donner parmi les fonctionnements
A et B représentés ci-dessous, celui correspondant à une circulation
des fluides à contre-courant.
Les deux fluides circulent dans le même sens : échangeur co-courant.
30. En exploitant
la relation de la puissance transférée dans un échangeur, montrer que
pour obtenir la puissance thermique annoncée (270 kW), le débit de
l’eau livrée à la piscine à 35°C doit être égal à 5,9 kg·s-1.
Puissance thermique reçue par l'eau froide : P = Qm C (TF2-TF1) ;
Qm = P / (C (TF2-TF1)) =270 103 / (4180 x11)=5,9 kg s-1.
31. Montrer que la moyenne logarithmique des différences de température entre les deux fluides Δ𝑇𝑇𝑚 est de 28°C.
Ecart de température logarithmique moyen DTm =(DT2 -DT1) / ln(DT2/DT1)
DT2 =65-35=30°C ; DT1 =50-24=26°C ;
DTm =(30-26) / ln(30 /26)=28°C.
32. En déduire la surface de l’échangeur à choisir, sachant que le coefficient global d’échange thermique U est égal à 4,0 kW·m-2·K-1.
Puissance transférée : P = U S DTm .
S = P / (U DTm)=270 / (4 x 28)=2,4 m2.
|
ane.
|
|
|