L’objectif
de cet exercice est de montrer comment la technique du dosage par
titrage a permis à Marcellin Berthelot de mettre en évidence les
notions de cinétique chimique et d’équilibre chimique.
1. Dosage par titrage.
Berthelot et Péan de Saint-Gilles ont réalisé un mélange contenant les
mêmes quantités de matière en acide éthanoïque et en éthanol laissé à
la température ambiante de 20 °C. Il s’est formé de l’éthanoate
d’éthyle et de l’eau. La transformation d’estérification qui s’est
déroulée était très lente. Elle peut être modélisée par l’équation de
réaction suivante :
CH
3COOH(ℓ) + C
2H
5OH(ℓ)=CH
3COOC
2H
5(ℓ)
+ H
2O(ℓ)
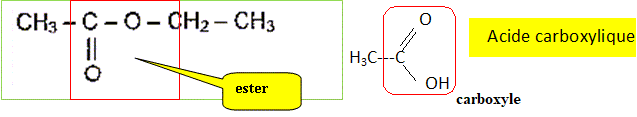
Q1. Représenter la
formule semi-développée de l’acide éthanoïque. Entourer et nommer le
groupe caractéristique de la molécule. Nommer la famille fonctionnelle
à laquelle appartient l’éthanoate d’éthyle.
La transformation s’étant poursuivie pendant quinze jours, un
échantillon du mélange réactionnel a alors été prélevé afin de
connaître l’évolution des quantités de matière des espèces chimiques en
jeu. Pour Marcellin Berthelot : « C’est évidemment l’acide qu’il faut
déterminer. On transvase (l’échantillon) dans un vase à fond plat. On
ajoute quelques gouttes de teinture de tournesol et l’on verse de l’eau
de baryte avec une burette graduée jusqu’à ce que la teinte rose du
tournesol ait viré au bleu franc. »
Données :
- Le vase à fond plat est un erlenmeyer ;
- La teinture de tournesol est un indicateur coloré acido-basique ;
- L’eau de baryte est une solution aqueuse d’hydroxyde de baryum : elle
contient les ions baryum Ba
2+(aq), spectateurs, et les ions
hydroxyde HO
−(aq) ;
-Couples acide / base mis en jeu : CH
3CO
2H(ℓ) / CH
3CO
2−(aq)
; H
2O(ℓ) / HO
−(aq).
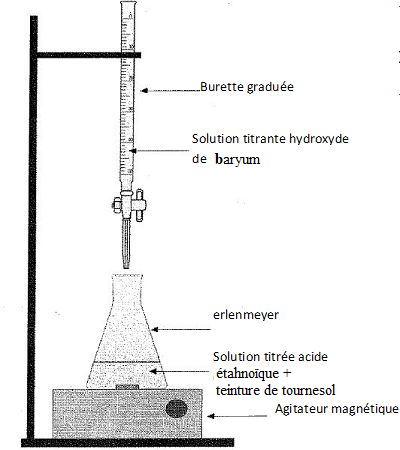
Q2. Faire un schéma
du dosage par titrage réalisé en y indiquant les positions de la
solution titrante et de la solution titrée.
 Q3.
Q3. Écrire
l’équation de réaction qui modélise la transformation lors du dosage
par titrage entre l’acide éthanoïque présent dans l’échantillon et les
ions hydroxyde provenant de la burette. Citer au moins une
caractéristique que doit posséder toute réaction utilisée pour un
dosage par titrage.
CH
3COOH aq + HO
-aq --> CH
3COO
-aq
+ H
2O(l).
La réaction doit être rapide et totale.
Q4. Indiquer la
teinte de la forme acide de l’indicateur coloré.
Rouge en milieu acide.
On considère une solution titrante de concentration en quantité de
matière C
b en ions hydroxyde HO
−(aq) de valeur
égale à 2,0 mol·L
–1 et provoquant le changement de couleur
pour un volume V
BE versé à l’équivalence de valeur égale à
5,0 mL.
Q5. En utilisant la
relation entre les quantités de matière à l’équivalence, calculer la
valeur de la quantité de matière n
A en acide éthanoïque dans
l’échantillon titré.
A l'équivalence : n
A = n
B = C
b V
BE
=2,0 x 5,0 = 10,0 mmol dans le volume V.
Données :
-Le volume de l’échantillon V vaut un centième du volume du mélange
réactionnel initial V
i ;
- Le dosage par titrage réalisé a montré que 10 % de l’acide initial
avait réagi.
Q6. Montrer que ce
mélange contenait initialement une quantité de matière d’acide n
i
de valeur égale à 1,1 mol.
Quantité de matière d'acide éthanoïque dans le mélange initial :
10,0 x 100 = 1000 mmol = 1,0 mol.
1,0 / 0,9 ~1,1 mol.