Coloration
capillaire,
bac Polynésie 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Étude de solutions oxydantes.
Les solutions oxydantes utilisées pour développer les colorations capillaires contiennent du peroxyde d’hydrogène H2O2(aq).
Il est possible de déterminer la concentration en quantité de matière
en peroxyde d’hydrogène d’une solution oxydante pour coloration
capillaire à l’aide d’un dosage par titrage. Le réactif titrant est le
permanganate de potassium en milieu acide.
L’équation de la réaction modélisant la transformation observée durant le dosage par titrage est :
2 MnO4– (aq) + 6 H+(aq) + 5 H2O2(aq) → 2 Mn2+(aq) + 5 O2(g) + 8 H2O(l)
La solution oxydante, notée S, est préalablement diluée au vingtième
ainsi sa concentration en quantité de matière est divisée par 20. La
solution obtenue est notée S20.
Q1. Donner le protocole, en indiquant la verrerie, qui permet de préparer un volume V de valeur égale à 100 mL de solution S20 à partir de la solution S.
Facteur de dilution F = 20.
Prélever 100 / 20 = 5,0 mL desolution mère à l'aide d'une pipette jaugée de 5,0 mL.
Verser dans une fiole jaugée de 100 mL contenant 1 /3 d'eau distillée.Agiter.
Compléter jusqu'au trait de jauge à l'aide d'eau distilée. Agiter pour rendre homogène.
On place un volume V1 de solution S20 dans un
erlenmeyer et on ajoute quelques gouttes d’une solution d’acide
sulfurique concentrée. La burette contient la solution de permanganate
de potassium (K+(aq) ; MnO4– (aq)) de concentration en quantité de matière c2. Le volume de solution de permanganate de potassium pour atteindre l’équivalence est noté VE.
Données :
Valeur du volume V1 : V1 = 10,0 mL ;
Valeur de la concentration en quantité de matière c2 de la solution de permanganate de potassium : c2 = 2,00×10–2 mol·L–1 ;
Valeur du volume VE de solution de permanganate de potassium versé à
l’équivalence : VE = 18,1 mL ;
Valeur de la masse molaire du peroxyde d’hydrogène : MH2O2= 34 g·mol–1.
Q2. Établir la relation à l’équivalence entre la quantité de matière du peroxyde d’hydrogène n1 et la quantité de matière n2E des ions permanganate.
2 moles d'ion permanganate réagissent avec 5 moles d'eau oxygénée.
n1 = 2,5 n2E.
Q3. Déterminer c1, la concentration en quantité de matière du peroxyde d’hydrogène de la solution S20.
n1 =2,5 x2,00 10-2 x18,1 10-3 =9,05 10-4 mol dans 10,0 mL soit 9,05 10-2 mol / L.
Q4. En déduire la concentration en quantité de matière c du peroxyde d’hydrogène dans la solution oxydante S.
c = 20 x 9,05 10-2 =1,81 mol / L.
Q5. Vérifier que la solution oxydante étudiée est la solution n°2. ( 6,0 % en eau oxygénée ; 1022 g / ; 20 volumes)
Le titre en volume correspond au volume de dioxygène libéré par la
décomposition en eau et en dioxygène d’un litre de solution de peroxyde
d’hydrogène dans les conditions normales de température et de pression.
L’équation de la réaction modélisant la décomposition du peroxyde d’hydrogène est la suivante :
2 H2O2(aq) → O2(g) + 2 H2O(l).
Masse d'eau oxygéne dans 1 L : 1,81 MH2O2 =1,81 x34 =61,54 g.
% d'eau oxygénée : 61,54 / 1022 =0,060 ( 6 %).
Q6. Vérifier que la
solution oxydante n°2 à 6,0 % en masse de peroxyde d’hydrogène dans la
solution correspond effectivement à un titre en volume de valeur proche
de 20 volumes.
nH2O2 = 1,81 mol ; nO2 =0,905 mol.
Titre en volume : 0,905 Vm = 0,905 x 22,4 ~ 20 volumes.
|
...
|
....
|
Étude de la crème colorante.
La crème colorante contient une espèce basique ammoniaque ou amine
organique dont la fonction est de fixer le pH du mélange colorant vers
une valeur de 9,5. À ce pH, les écailles du cheveu s’ouvrent pour
laisser les précurseurs des espèces colorées pénétrer abondamment la
fibre.
Données :
Couple acide-base ion ammonium / ammoniac : NH4+ (aq) / NH3(aq) ;
Q7. Écrire l’équation de la réaction modélisant l’action de l’eau sur l’ammoniac NH3(aq).
NH3 aq + H2O (l) = NH4+aq + HO-aq.
Soit une solution aqueuse de concentration en quantité de matière cA d’ammoniac de valeur égale à 1,00×10–2 mol·L–1. La valeur du pH de cette solution est égale à 10,6.
Q8. Montrer que l’ammoniac est une base faible dans l’eau.
Dans l'hypothèse d'une base forte : pH = 14 + log c = 14 + log (0,01) = 12.
Or le pH mesuré est inférieuir à 12, donc l'ammoniaque est une base faible.
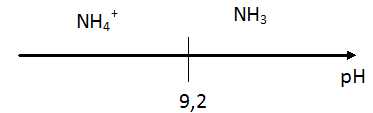
La valeur du pH mesurée dans le « mélange prêt à l’application » est égale à 9,2.
Donnée :
Valeur du pKA du couple ion ammonium / ammoniac à 25°C : pKA = 9,2.
Q9. Tracer le diagramme de prédominance du couple ion ammonium / ammoniac.
Q10. Recopier la formule topologique de la molécule 2, entourer et nommer les groupes caractéristiques présents.
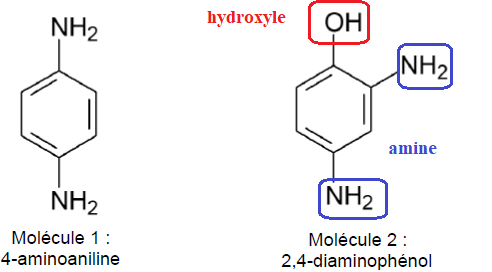
Les coupleurs sont un peu moins sensibles à l’oxydation que les
molécules précédentes. Une relation structurelle, ou isomérie de
constitution, entre les deux types de structure est responsable de
cette différence. Le document suivant présente un coupleur le
3-aminoaniline.
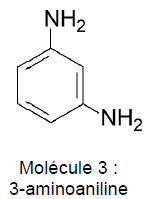
Q11. Nommer la catégorie de l’isomérie de constitution entre la molécule 3 et la molécule 1.
Isomérie de position : les groupes amine sont placés sur des atomes de carbone différents..
Développement de la couleur.
Lorsque l’on mélange la crème colorante et la solution oxydante, une
espèce colorée apparaît peu à peu. Cette espèce est capable de teindre
le cheveu en s’insérant à l’intérieur de la fibre capillaire. Le
développement de cette couleur peut être étudié au spectrophotomètre.
Lorsque la solution n’est pas trop concentrée, elle suit la loi de
Beer-Lambert, qui peut permettre de vérifier la teneur en coupleur de
la crème colorante.
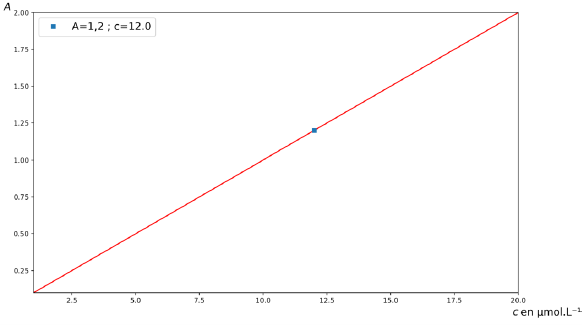
Pour réaliser une simulation de la loi de Beer-Lambert, on choisit
d’utiliser un programme Python, qui lorsqu’il a été exécuté donne le
résultat présenté figure suivante.
Les solutions de la gamme d’étalonnage envisagée contiennent le
colorant capillaire obtenu par oxydation de l’espèce qu’on appellera
par la suite molécule C dans une gamme de concentration en quantité de
matière comprise entre 1,0×10–6 mol·L–1 à 2,0×10–5 mol·L–1.
Données :
La valeur de la longueur l de la cuve est égale à 1,0 cm ;
La valeur du coefficient d’extinction molaire e (epsilon) de l’espèce colorée est égale à 1,00×105 L·mol–1·cm–1 ;
La loi de Beer-Lambert appliquée dans son domaine de validité s’écrit A= e·l·c avec A la valeur de l’absorbance, e
le coefficient d’extinction molaire de l’espèce, c la valeur de la
concentration et l la valeur de la longueur de la cuve du
spectrophotomètre.
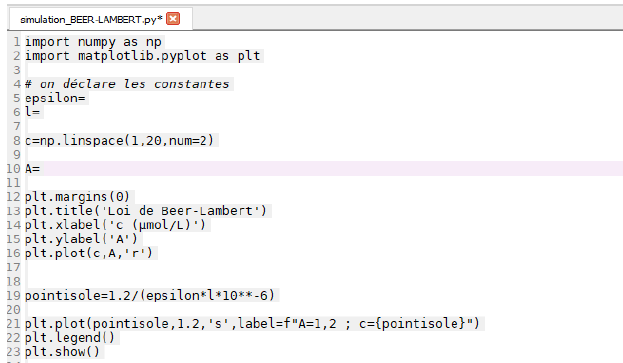
Q12. Recopier et compléter les lignes 5, 6 et 10 du code Python.
Ligne 5 : epsilon = 1.00**-5
Ligne 6 : l=1.0
Ligne 10 : A =eplsilon*l*c
Le programme affiche également la valeur de la concentration en
quantité de matière correspondant à une absorbance A = 1,20 pour un
échantillon préparé en diluant 100 fois le mélange crème colorante -
solution oxydante.
On considèrera que les valeurs numériques des masses volumiques de la
crème et de l’oxydant sont proches de celle de l’eau, constituant
majoritaire du mélange. Le mélange est préparé en réunissant des
volumes égaux de crème colorante et de solution oxydante.
Le développement de la couleur se fait selon l’équation simplifiée de réaction :
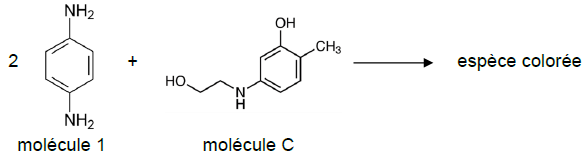
Q13. Déterminer la concentration Cc en quantité de matière de la molécule C dans le mélange.
Donnée :
La masse molaire de la molécule C : MC = 169 g·mol–1.
Cdiluée = 12 µmol / L ; Créelle = 100 x 12 10-6 =1,2 10-3 mol / L.
Q14. La législation
autorise jusqu’à 1,5% en masse de la molécule C dans le mélange
colorant prêt à l’emploi. Vérifier que la crème colorante respecte la
législation.
Masse de la molécule C : MC x 1,2 10-3 =169 x1,2 10-3 =0,20 g dans 1 L ( 1000 g).
0,20 / 1000 x100 = 0,02 %.
On enregistre, figure 7, le spectre du « mélange prêt à l’application » après le développement de la couleur.
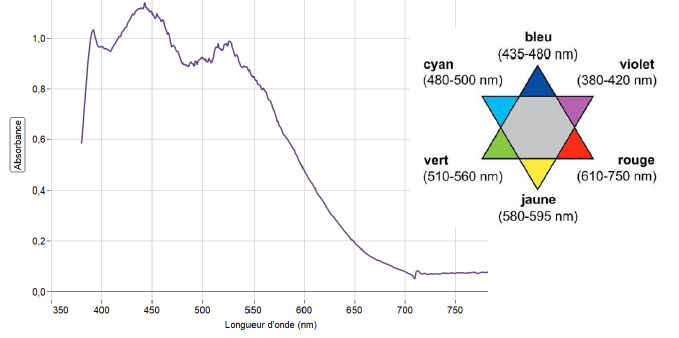
Q15. Déterminer la couleur principalement absorbée et en déduire la couleur dominante du mélange « mélange prêt à l’application ».
Le maximum d'absorption se situe vers 450 nm ( bleu). La couleur
dominante du mélange est la couleur complémentaire du bleu, c'est à
dire le jaune.
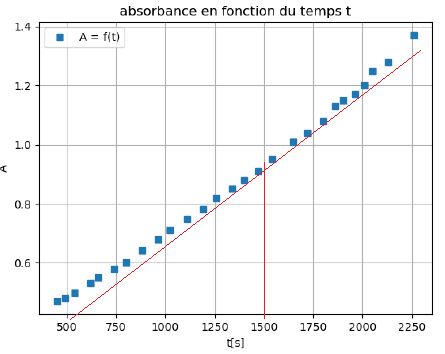
On suit l’évolution de l’absorbance en fonction du temps, la courbe obtenue est donnée.
Q16. Donner la définition de la vitesse d’apparition du produit coloré, notée vproduit.
vproduit = d C /dt.
Q17. À partir de l’expression de la loi de Beer-Lambert, montrer que l’expression de la vitesse d’apparition du produit coloré est :
vproduit = 1 / (e l) dA /dt.
C = A /(el) ; vproduit = 1 / (e l) dA /dt.
Données :
La valeur de la longueur l de la cuve est égale à 1,0 cm ;
La valeur du coefficient d’extinction molaire e de l’espèce colorée est égale à 1,00×105 L·mol–1·cm–1.
Q18. Déterminer la vitesse d’apparition du produit v1500 à la date 1500 s.
Coefficient directeur de la tangente à la courbe à t = 1500 s :
dA/dt ~1,2 / (2000 -500) =0,0008 s-1.
vproduit = 1 /(1,00 105 )x0,0008 =8 10-9 mol L-1 s-1.
|
ane.
|
|
|