Batterie
lithium soufre,
bac Métropole 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
L’objectif de cet exercice est d’étudier quelques caractéristiques d’une batterie lithium – soufre et de les
comparer à celles d’une batterie lithium – ion.
La batterie lithium – soufre peut être modélisée de façon simplifiée :
elle se compose d’une électrode constituée d’un matériau contenant du
soufre, un électrolyte organique anhydre et une électrode de lithium
métallique.
1. Le lithium
Le lithium réagit spontanément avec l’eau. Cette transformation est exothermique. L’équation de la réaction
modélisant cette transformation supposée totale s’écrit :
2 Li (s) + 2 H2O (l) --> 2 Li+ (aq) + 2 HO– (aq) + H2 (g)
La batterie d’un téléphone portable contient en moyenne une masse m = 0,5 g de lithium.
Q1. Justifier que le lithium se comporte comme un réducteur dans cette transformation.
Li(s) --> Li+aq +e-.
Le lithium cède des électrons ; c'est un réducteur qui s'oxyde.
Q2. Déterminer le volume de dihydrogène formé, à 20°C et à pression atmosphérique, si une masse m = 0,5 g
de lithium réagit totalement avec l’eau. Justifier l’utilisation d’un électrolyte organique anhydre dans une telle batterie.
Quantité de matière de lithium : n = m / M(Li) =0,5 / 6,9 = 0,0724 mol.
Quantité de matière de dihydrogène : ½n = 0,00362 mol.
Volume de dihydrogène V = ½n Vm = 0,00362 x24,4 =0,88 ~0,9 L.
Avec un électrolyte contenant des traces d'eau, le lithium s'oxyde et donne un dégagement de dihydrogène.
2. La batterie lithium – soufre
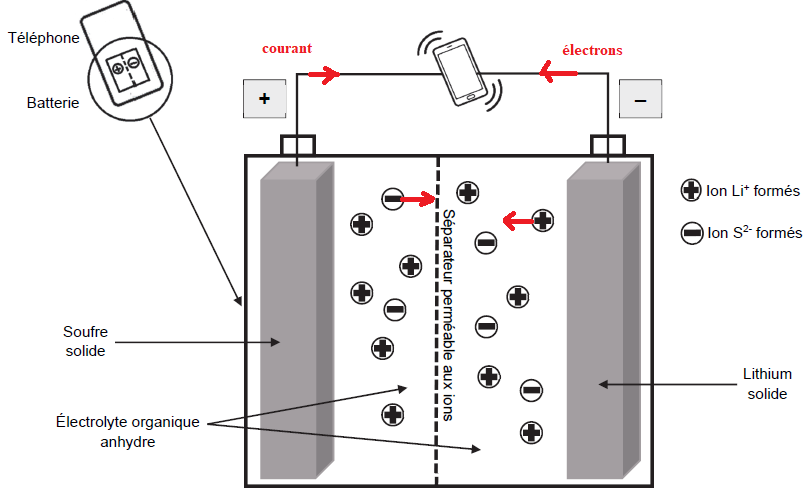
On donne le schéma simplifié de la batterie lithium – soufre quand elle
se décharge, c’est-à-dire quand elle fonctionne en tant que pile. Les
pôles de cette pile sont indiqués.
Q3. Écrire les
demi-équations modélisant les réactions électrochimiques qui se
déroulent alors à chaque électrode en tenant compte de la polarité de
la pile.
Oxydation à l'anode négative : 2 Li(s) --> 2Li+aq +2e-.
Réduction du soufre à la cathode positive : S(s) + 2e- --> S2-(aq)
Q4. Sur le schéma où la polarité de la pile est donnée, indiquer :
- le sens du courant électrique ;
- le sens de déplacement des électrons dans les fils électriques reliant la pile au téléphone ;
- le sens de déplacement des ions formés dans l’électrolyte.
Q5. Écrire l’équation de fonctionnement de la pile en tenant compte de la formation d’un précipité dans la pile.
Ajouter les deux demi-équations :
2 Li (s)+ S(s) --> Li2S(s)
Une batterie lithium – ion de smartphone, de capacité de Q = 3 500 mAh,
débite un courant d’intensité I = 0,55 A supposée constante, lors de
l’utilisation de la fonction lampe torche. La batterie se comporte dans
ce contexte comme une pile. La capacité massique moyenne par gramme de
matière active d’une batterie lithium – ion a pour valeur Qmassique = 300 mAh·g–1.
Q6. Déterminer la durée d’utilisation de la batterie lithium – ion dans ces conditions.
Durée = Q / I = 3,5 / 0,55 ~6,4 heures.
Q7. Vérifier, à l’aide des données, qu’une batterie lithium – ion neuve contient environ 12 g de matière active.
En déduire la durée d’utilisation ramenée à un gramme de matière active dans ces conditions d’utilisation.
Qmasssique x masse = Q ; masse = 3500 / 300 =11,7 ~ 12 g.
6,4 / 12 = 0,53 heure / gramme ou 32 minutes / gramme.
Q8. Déterminer la capacité massique par gramme de soufre actif de la batterie lithium – soufre, exprimée
en mAh·g–1. En déduire sa durée d’utilisation par gramme de soufre actif si elle débite un courant d’intensité
I = 0,55 A supposée constante. Commenter.
Masse de soufre m = 1 g.
Quantité de matière de soufre n = 1 /M(S) = 1 / 32,1 =0,03115 mol.
S(s) + 2e- --> S2-(aq)
Quantité de matière d'électrons : 2 n = 0,0623 mol.
Q = 2 e F = 0,0623 *96500 =6012 C ou 6012 / 3,6 = 1670 mAh= 1,67 Ah.
Durée de fonctionnement : 1,67 / 0,55 =3 heures par gramme de soufre,
c'est à dire 6 fois plus longtemps que la batterie lithium - ion.
Mais il faudrait tenir compte de la masse totale de substance active lithium et soufre, pour une comparaison plus rigoureuse.
|