Un
champignon parfumé,
bac Métropole 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
La rareté et le coût élevé du
champignon matsutake incitent l’industrie agro-alimentaire à
synthétiser le cinnamate de méthyle.
On se propose dans cet exercice d’étudier une synthèse de laboratoire
de cet arôme.
1. Étude des réactifs de la synthèse du cinnamate de méthyle
Le cinnamate de méthyle peut être synthétisé à partir du méthanol et de
l’acide cinnamique, appelé acide 3-phénylprop-2-énoïque en nomenclature
systématique.
Q1. Nommer la famille fonctionnelle à laquelle appartient l’acide cinnamique. Justifier.
Présence du groupe carboxyle -COOH , famille des acides carboxyliques.
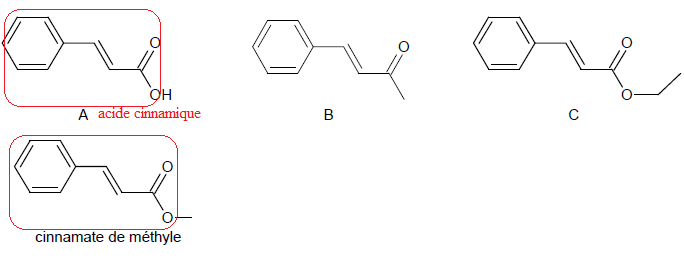
Q2. En déduire,
parmi les trois composés A, B et C dont les formules topologiques sont
données ci-dessous, celui qui correspond à l’acide cinnamique.
Justifier.
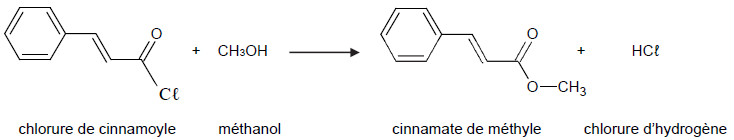
2. Synthèse du cinnamate de méthyle à partir du chlorure de cinnamoyle
Dans les conditions expérimentales choisies, la réaction de synthèse du
cinnamate de méthyle à partir de l’acide cinnamique et du méthanol se
produit avec un rendement de l’ordre de 40 %. On préfère alors faire
réagir le méthanol avec le dérivé chloré de l’acide cinnamique : le
chlorure de cinnamoyle. La transformation chimique est supposée totale
et l’équation de la réaction modélisant la synthèse est la suivante :
Q3. Parmi les catégories suivantes, identifier celle à laquelle appartient cette transformation :
oxydoréduction, acide-base, addition, élimination, substitution.
Substitution : C-Cl est remplacé par C-O-CH3.
Le protocole de la synthèse du cinnamate de méthyle peut se présenter en deux étapes.
• Étape 1 : formation du cinnamate de méthyle
- verser 5 mL de dichlorométhane dans un ballon de 100 mL contenant 8,3 g de chlorure de cinnamoyle et
surmonté d’un tube réfrigérant ;
- une fois le chlorure de cinnamoyle totalement dissous, ajouter 4,0 mL de méthanol ;
- chauffer à reflux pendant 10 min.
• Étape 2 : isolement du produit de synthèse
- une fois refroidi, laver le mélange réactionnel avec une solution aqueuse d’hydrogénocarbonate de
sodium (Na+(aq) ; HCO3 – (aq)) de concentration 0,50 mol∙L−1 jusqu’à ce que le milieu ne soit plus acide ;
- sécher la phase organique contenant le cinnamate de méthyle, puis filtrer ;
- évaporer le dichlorométhane, puis récupérer le produit solide synthétisé.
Q4. Indiquer, en
les justifiant, les consignes de sécurité qu’il est nécessaire de
prendre lors de la mise en oeuvre de ce protocole.
Port de blouse, lunettes et gants.
Le dichlorométhane étant nocif et dangereux pour la santé, travail sous hotte aspirante.
Q5. Justifier l’utilisation du dichlorométhane comme solvant lors de l’étape 1 de la synthèse.
Le
dichlorométhane et le chlorure de cinnamoyle sont tout deux solubles
dans le dichloorométhane ; les réactifs doivent se trouver dans la même
phase.
|
...
|
....
|
Dans
l’étape 2, lorsqu’on ajoute la solution aqueuse d’hydrogénocarbonate de
sodium dans le milieu réactionnel, le chlorure d’hydrogène HCℓ réagit
totalement avec l’eau pour former des ions H3O+ et des ions chlorure Cℓ–. Les ions H3O+ formés réagissent avec les ions hydrogénocarbonate. On observe une effervescence.
Q6. Écrire l’équation de la réaction ayant lieu entre les ions H3O+et les ions hydrogénocarbonate HCO3 – .
Justifier l’observation d’une effervescence.
H3O+ aq+HCO3 – aq--> CO2(g) + 2H2O(l).
L'effervescence est due au dégagement de dioxyde de carbone.
Q7. Déterminer le volume minimal de solution aqueuse d’hydrogénocarbonate de sodium nécessaire à la disparition complète des ions H3O+ produit par le chlorure d’hydrogène HCℓ, en supposant la synthèse totale.
n(chlorure de cinnamoyle) = m / M =8,3 / 166,6 =0,0498 mol.
n (méthanol) =volume x masse volumique / masse molaire = 4,0 x 0,792 / 32 =0,099 mol. ( en excès).
n(HCl ) =0,0498 mol.
n(HCO3 – aq) = 0,0498 mol.
Volume d’hydrogénocarbonate de sodium = n(mol ) / concentrtion (mol / L) =0,0498 /0,50 =0,0996 L ~ 100 mL.
Q8. La masse du
produit solide obtenu expérimentalement vaut m = 6,2 g. Estimer le
rendement de la synthèse en supposant que le produit obtenu est pur.
Commenter.
n(produit) théorique =0,0498 mol.
Masse théorique = n M = 0,0498 x162,2 ~8,1 g.
Rendement = masse réelle / masse théorique = 6,2 / 8,1 ~0,77 (77 %).
Rendement bien supérieur à l'autre procédé de synthèse ( 40 %).
|
ane.
|
|
|