L'acide
citrique comme produit ménager,
bac Métropole 09 / 2024
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Le
but de cet exercice est de déterminer la quantité de matière d’acide
citrique présente dans le jus extrait d’un citron puis de vérifier
l’indication « 1 pelle doseuse = la puissance de 10 citrons » notée sur
l’emballage d’unproduit ménager.
1. Étude de quelques propriétés de l’acide citrique
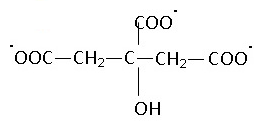
Q1. Nommer les groupes caractéristiques 1 et 2 encadrés sur la formule topologique de l’acide citrique.
Préciser celui qui est responsable des propriétés acides de la molécule dans l’eau.
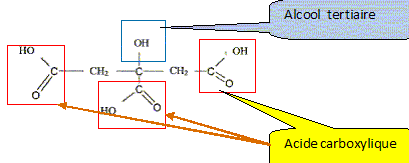
Les groupes carboxyles COOH sont rsponsables de l'acidité.
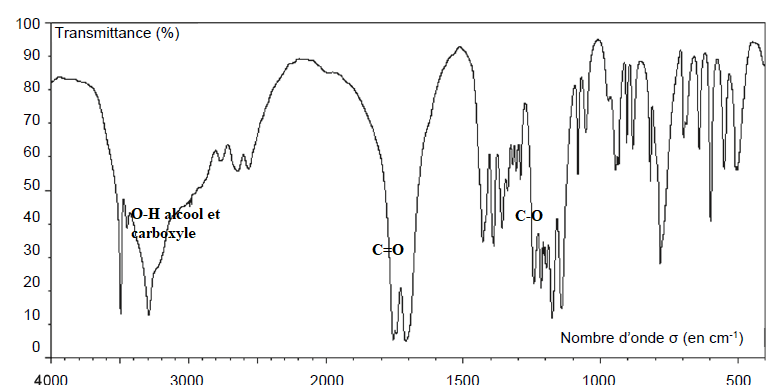
Q2. Justifier que le spectre infrarouge ci-dessous est compatible avec la structure chimique de l’acide citrique.
La solubilité de l’acide citrique dans l’eau à 25 °C est égale à 592 g·L–1. La solubilité de l’hexane dans l’eau
vaut 9,5 mg·L–1.
Q3. Proposer une explication de la différence entre ces deux valeurs de solubilité.
L'acide citrique et l'eau, sont des molécules polaires.
L'hexane est une molécule apolaire, très peu soluble dans un solvant polaire.
Q4. Attribuer à chaque courbe numérotée du diagramme de distribution de l’acide citrique l’espèce chimique
correspondante. Justifier ces attributions.
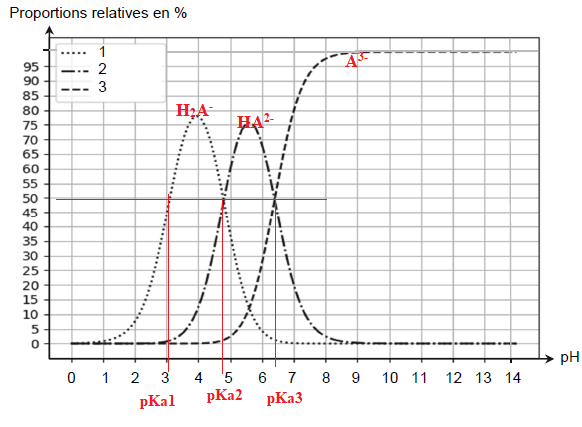
A pH > pKa3, A3- prédomine.
A pH compris entre pKa2 et pKa3, HA2- prédomine.
A pH compris entre pKa1 et pKa2, H2A- prédomine.
L’équation modélisant la réaction entre l’acide citrique H3A et l’eau est :
H3A(aq) + H2O(ℓ)→ H2A–(aq) + H3O+(aq)
On dispose au laboratoire d’une solution aqueuse d’acide citrique de concentration c = 2,6×10–2 mol·L–1. Son
pH vaut environ 2,3.
Q5. Estimer, à l’aide du diagramme de distribution, les proportions en pourcentage de chaque espèce acidobasiques
H3A et H2A– de cette solution.
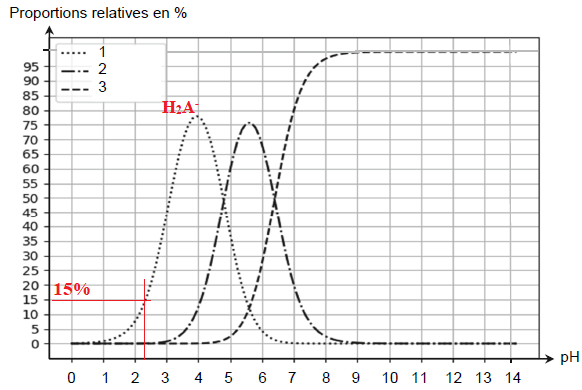
H3A : 85 % et H2A– : 15 %.
Q6. En déduire, par le calcul, qu’à pH = 2,3 les concentrations des espèces chimiques H3A et H2A– sont
voisines de [H3A]éq = 2,2×10–2 mol·L–1 et [H2A–]éq = 3,9×10–3 mol·L–1.
[H3A]éq =0,85 c = 0,85 x2,6×10–2 =2,2×10–2 mol·L–1 .
[H2A–]éq =0,15 c =0,15 x2,6 10-2= 3,9×10–3 mol·L–1.
Q7. Donner l’expression de la constante d’acidité Ka1 du couple H3A(aq)/H2A–(aq) en fonction des
concentrations en quantité de matière à l’équilibre [H3A]éq, [H2A–]éq, [H3O+]éq et de la concentration standard c°.
En déduire l’égalité [H2A–]éq / [H3A]éq = 10pH-pKa1.
Ka1 = [H2A–]éq [H3O+]éq / ( [H3A]éq c°) avec c° = 1.
[H2A–]éq / [H3A]éq =Ka1 / [H3O+]éq.
pKa1 =- log Ka1 ; pH = -log [H3O+]éq.
Ka1 = 10-pKa1 ; [H3O+]éq = 10-pH ; Ka1 / [H3O+]éq =10pH-pKa1.
Q8. Déterminer si les proportions du diagramme de distribution à pH = 2 ,3 sont cohérentes avec la valeur du
quotient [H2A–]éq / [H3A]éq calculée à l’aide de la relation démontrée la question Q7.
10pH-pKa1=102,3-3,1~0,16.
[H2A–]éq / [H3A]éq =15 / 85~0,176.
Ces deux valeurs sont cohérentes.
|
...
|
....
|
2. Titrage de l’acide citrique
Dans cette partie, on cherche à déterminer expérimentalement la
masse d’acide citrique présente dans un citron. Le protocole
expérimental suivant est réalisé :
- presser un citron avec un presse-agrumes ;
- filtrer le jus obtenu. Le volume de jus mesuré vaut Vjus = 46 mL après filtration ;
- diluer 10 fois le jus de citron filtré ;
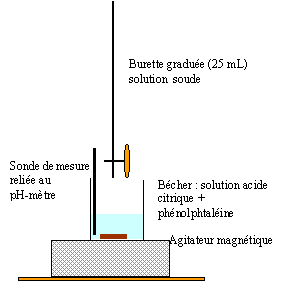
- prélever un volume Vdilué = 25,0 mL de jus de citron dilué et
réaliser le titrage par une solution aqueuse d’hydroxyde de sodium de
concentration Cb = 0,25 mol·L–1, à l’aide d’un suivi pH-métrique.
Les valeurs des trois pKA de l’acide citrique étant proches, les trois acidités sont titrées simultanément.
L’équation de la réaction support du titrage s’écrit :
H3A(aq) + 3 HO–(aq) → A3–(aq) + 3 H2O(ℓ)
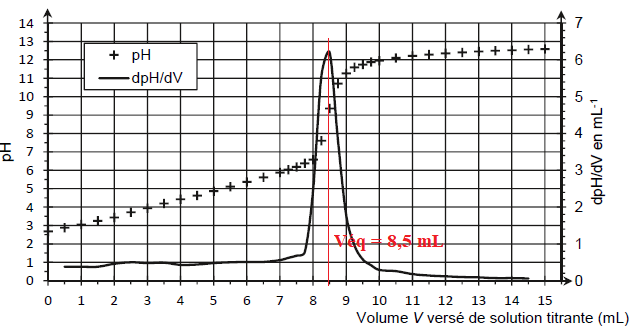
La courbe de titrage obtenue est représentée.
Q9. À partir de la formule topologique de l’acide citrique H3A, représenter la formule semi-développée de l’ion A3–.
Q10. Proposer un protocole expérimental permettant de diluer 10 fois le jus de citron filtré. Justifier la verrerie
utilisée.
Prélever 10,0 mL de jus de citron à l'aide d'une pipette jaugée.
Verser dans une fiole jaugée de 100 mL contenant 1 /3 d'eau distillée. Agiter.
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Boucher, agiter pour rendre homogène.
Q11. Réaliser un schéma légendé du dispositif de titrage, en nommant le matériel et les solutions utilisées.
Q12. Choisir dans le tableau ci-dessous, en justifiant, un indicateur coloré adapté à ce titrage. Préciser, en
justifiant, le changement de couleur de l’indicateur coloré à l’équivalence.
Le pH du point équivalent est proche de 9,3. La zone de virage de l'indicateur coloré doit contenir cette valeur :
La phénolphtaléine convient : la solution incolore passe au rose à l'équivalence.
Q13. En supposant
que l’acide citrique est le seul acide présent dans le fruit,
déterminer la masse d’acide citrique présente dans le citron.
A l'équivalence n(HO-) =Cb Véqui = 0,25 x8,5 =2,125 mmol.
n (H3A) = n(HO-) / 3 = 2,125 / 3 =0,708 mmol dans 25 mL
C = 0,708 / 25=0,0283 mol / L.
Tenir compte de la dilution au dixième : 0,283 mol / L.
Soit 0,283 x46 / 1000 =0,013 mol dans le jus issu d'un citron.
M(acide citrique) =192,1 g/mol.
Masse d'acide citrique : 192,1 x0,013 =2,5 g.
Avec un protocole similaire, on détermine que la masse d’acide citrique contenue dans une pelle-doseuse est égale à 23 g.
Q14. En déduire le nombre de citrons apportant la même masse d’acide citrique. Commenter.
23 /2,5 ~ 9 citrons.
L'indication « 1 pelle doseuse = la puissance de 10 citrons » est correcte.
|
ane.
|
|
|






