Traitement
contre le varroa, acide oxalique,
bac Métropole 09 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
L’apiculteur surveille ses ruches et peut
freiner la croissance de la population de varroas grâce à un traitement
à base d’acide oxalique. Cependant à trop forte dose, cet acide peut
être néfaste pour les abeilles. Le
traitement consiste alors à laisser tomber goutte à goutte une solution
sucrée d’acide oxalique dans la ruche.
L’objectif de cet exercice est de vérifier qu’une solution d’acide
oxalique préparée pour traiter une ruche est
conforme aux recommandations d’utilisation.
À partir d’une solution S commerciale sucrée d’acide oxalique, on prépare une solution S1 en diluant 10 fois
la solution S.
Q1. Proposer une formule développée de la molécule d’acide oxalique sachant qu’elle comporte deux
fonctions acide carboxylique.
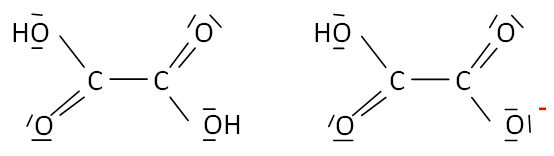 Q2. Rédiger un protocole expérimental permettant de préparer un volume de 100,0 mL de solution S1 à partir
de la solution S en justifiant la verrerie choisie.
Q2. Rédiger un protocole expérimental permettant de préparer un volume de 100,0 mL de solution S1 à partir
de la solution S en justifiant la verrerie choisie.
Facteur de dilution F = 10.
Prélever 10,0 mL de solution mère à l'aide d'une pipette jaugée et
verser dans une fiole jaugée de 100,0 mL contenant 1/3 d'eau distillée.
Agiter.
Compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendes homogène.
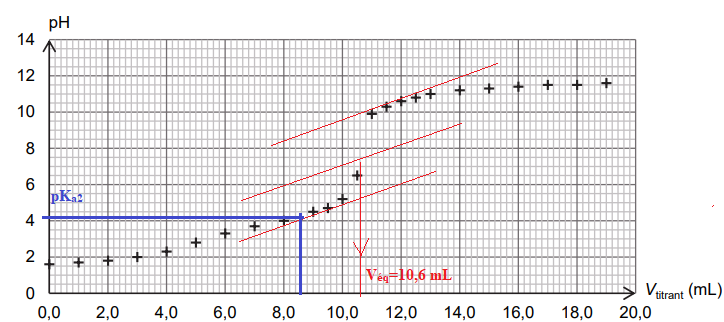
On dose par titrage avec suivi pH-métrique un volume V = 20,0 mL de solution diluée S1 par une solution
aqueuse titrante d’hydroxyde de sodium de concentration c = 1,0×10-1 mol∙L-1. La figure 1 ci-dessous
présente l’évolution du pH du milieu réactionnel en fonction du volume versé de solution titrante.
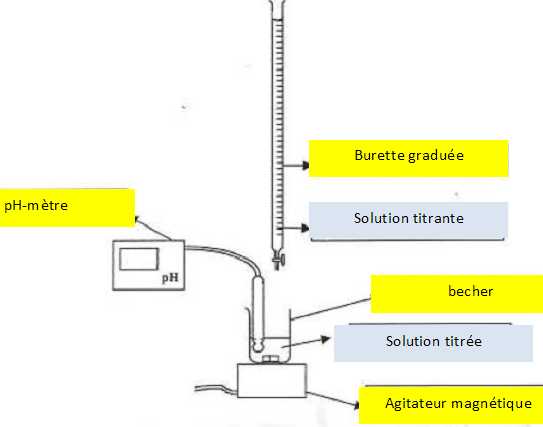
Q3. Schématiser et légender le montage du dosage par titrage avec suivi pH-métrique de la solution diluée S1
par une solution aqueuse d’hydroxyde de sodium.
 Q4. À l’aide d’un diagramme de prédominance, déterminer, en justifiant, la forme acide-base associée à l’acide
oxalique qui est présente en plus grande quantité dans la solution diluée S1 avant l’ajout de la solution aqueuse
d’hydroxyde de sodium.
Q4. À l’aide d’un diagramme de prédominance, déterminer, en justifiant, la forme acide-base associée à l’acide
oxalique qui est présente en plus grande quantité dans la solution diluée S1 avant l’ajout de la solution aqueuse
d’hydroxyde de sodium.
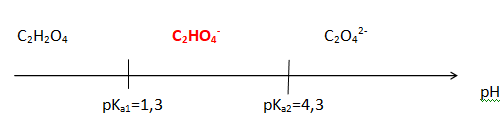
Le pH initial est voisin de 1,8. A pH compris entre pKa1 et pKa2, la forme C2HO4- prédomine.
|
...
|
....
|
À l’aide d’un programme informatique, il est possible de tracer l’évolution des quantités de matière des
différentes formes de l’acide oxalique au cours du titrage. La figure ci-dessous en propose une
représentation.
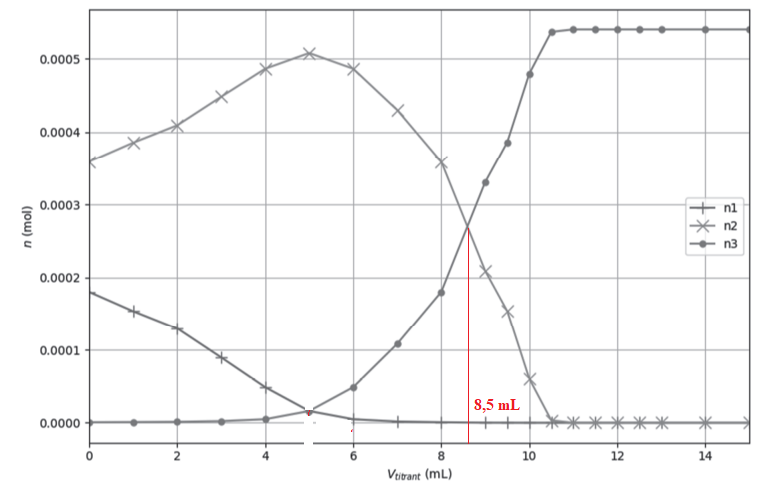
Q5. Attribuer, en justifiant, chaque courbe n1, n2 et n3 à la forme acido-basique correspondante de l’acide oxalique.
n1 : au début du titrage C2HO4- prédomine.
n3 : en fin de titrage, la forme C2O42- prédomine.
n2 : la forme C2H2O4 est minoritaire au début du titrage puis diminue jusqu'à s'annuler.
Q6. En utilisant les figures, expliquer comment on peut retrouver la valeur du pKa2.
A pH = pKa2, [C2O42- ] [C2HO4- ]. Le volume de solution titrante est alors égal à 8,5 mL.

La transformation chimique mise en jeu lors du titrage est modélisée par la réaction d’équation :
C2H2O4(aq) + 2 OH–
(aq) →C2O42-(aq) + 2 H2O(ℓ)
Q7. Exploiter les résultats du titrage pour déterminer la valeur de la concentration en masse en acide oxalique
dihydraté de la solution commerciale S. Commenter en vous appuyant sur les recommandations d’utilisation
de l’acide oxalique pour un traitement des ruches par goutte à goutte.
A l'équivalence n(HO-)=2 n(acide oxalique).
n(HO-)= c Véq = 0,10 x10,6 = 1,06 mmol.
n(acide oxalique) = 1,06 / 2 = 0,53 mmol dans 20 mL
Concentration =0,53 / 20 =0,0265 mol / L.
Tenir compte de la dilution : 10 x0,0265 ~0,27 mol/ L.
Masse molaire de l'acide oxalique : 126 g/mol.
Concentration massique : 0,265 x126 ~33 g / L.
Bonne efficacité contre varroa, bien tolérée par les abeilles.
|
ane.
|
|
|