Vers
le bleu de thymol,
bac Métropole 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
..
.
|
..
..
......
...
|
1. Extractions successives.
Le thym est une petite plante cultivée depuis l’antiquité dans les
régions du pourtour méditerranéen. Appréciée en cuisine pour ses
arômes, la plante est également utilisée pour ses vertus thérapeutiques
dues au thymol, constituant principal de l’espèce de thym étudiée dans
cet exercice.
Données :
Le thymol, à température ambiante, se présente sous la forme de cristaux incolores à l’odeur caractéristique ;
la solubilité du thymol est faible dans l’eau et forte dans les solvants organiques.
Le traitement d’un échantillon de 100 g de thym d’origine française
permet d’obtenir au maximum 2 g d’huile essentielle de thym ;
La configuration électronique de l’oxygène dans son état fondamental est : (1s)2(2s)2(2p)4 ;
l’hexane est un solvant organique de densité d = 0,66 et non miscible à l’eau ;
le couple thymol / ion thymolate est noté : R–OH / R–O –.
Q1. Écrire la formule semi-développée du thymol puis entourer et nommer son groupe caractéristique.
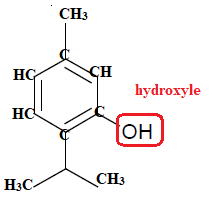
Q2. Représenter le schéma de Lewis de l’ion thymolate.
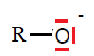
Du thym à l’huile essentielle de thym
L’hydrodistillation est l’une des techniques d’extraction des huiles essentielles préconisées par la législation européenne.
Suite à l’hydrodistillation d’un échantillon de thym, on réalise une chromatographie sur couche mince de l’huile
essentielle obtenue, les échantillons étant solubilisés dans un solvant adapté. Le chromatogramme est représenté.
Q3. Justifier que l’huile essentielle obtenue expérimentalement est un mélange qui contient du thymol.
L'huile essentielle obtenue expérimentalement est un mélange de trois
constituants ( présence de trois taches), dont l'un est le thymol (
même rapport frontal que le thymol).
De l’huile essentielle au thymol
Un article scientifique propose le protocole d’extraction du thymol de l’huile essentielle suivant :
- ajouter 1,0 mL d’huile essentielle de thym à 5 mL de solution aqueuse d’hydroxyde de sodium ;
- après chauffage dans un four à micro-ondes, éliminer la phase
huileuse puis acidifier la phase aqueuse à l’aide d’acide chlorhydrique
;
- ajouter de l’hexane, agiter, laisser décanter et récupérer la phase contenant le thymol.
Après évaporation du solvant, on obtient des cristaux dont la masse
correspond à 31 % de la masse de thymol présent initialement dans
l’huile essentielle.
D’après Journal of Medicinal Plants and By-products, 2021
Donnée :
Le pourcentage massique moyen en thymol de l’huile essentielle de thym est de 53 %.
Q4. Écrire l’équation de la réaction modélisant l’action de l’acide chlorhydrique sur l’ion thymolate R–O –.
R-O- aq+ H3O+aq --> ROH aq + H2O (l).
Q5. En déduire la nature et la position de la phase dans laquelle se trouve le thymol à l’issue de la décantation.
Le thymol se trouve sous la forme R-OH, peu soluble dans l'eau, mais très soluble dans l'hexane.
Le thymol est donc dans la phase organique, l'hexane.
Q6. Montrer que la masse de plante de thym à utiliser pour obtenir 1 g de thymol vaut près de 300 g.
100 g de thym permettent d'obtenir 2 g d'huile essentielle de thym.
Masse de thymol dans cet huile : 2 x 0,53 =1,06 ~1 g.
Il n'y a que 31 % de thymol dans les cristaux.
Masse de la plante de thym : 100 / 0,31 ~ 300 g.
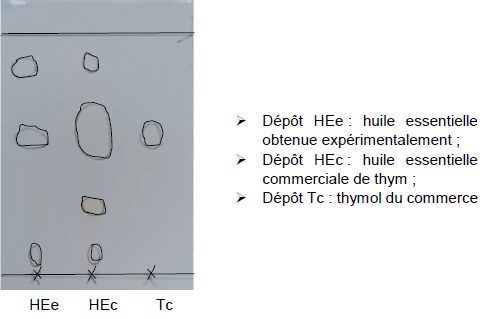
2. Synthèse du thymol
Le thymol utilisé dans les produits pharmaceutiques est principalement
obtenu par synthèse. Le thymol peut être industriellement synthétisé à
partir de m-crésol et de propène en excès, en présence d’oxyde
d’aluminium, qui joue ici le rôle de catalyseur. Cette transformation
génère plusieurs produits secondaires et rend complexe l’obtention
sélective du thymol.
Q7. Déterminer si les produits secondaires P2 et P4 de la réaction sont des isomères du thymol.
P2 a même formule brute que le thymol : c'est un isomère du thymol.
P4 n'a pas la même formule brute que le thymol : ce n'est pas un isomère du thymol.
De nombreux catalyseurs ont récemment été développés dans le but, entre autres, de réduire la température de la
synthèse et d’obtenir une sélectivité maximale en thymol.
Q8. Donner la définition d’un catalyseur et indiquer en quoi son utilisation peut permettre de « réduire la température
de la synthèse ».
Un catalyseur permet d'accélérer une réaction chimique et d'en diminuer la durée.
La température étant un facteur cinétique, en présence de catalyseur il
n'est pas nécessaire d'augmenter la température pour augmenter la
vitesse de la réaction..
On considère que la transformation entre le m-crésol et le propène
n’est pas totale et que l’état final de la transformation est un état
d’équilibre chimique.
Q9. Expliquer l’intérêt d’introduire le propène en excès dans cette synthèse industrielle.
L'utilisation du propène ( un réactif ) en excès déplace
l'équilibre dans le sens direct et en conséquence augmente le taux
d'avancement final et le rendement.
Une distillation fractionnée industrielle permet de purifier le thymol
et de récupérer le m-crésol n’ayant pas réagi en vue de son recyclage.
Q10. Justifier que
le thymol et le m-crésol peuvent a priori être séparés lors de la
distillation fractionnée. Indiquer l’espèce que l’on récupèrerait en
premier.
Cette distillation permet de séparer des liquides miscibles de températures d'ébullition bien différentes ( m-crésol : Téb = 203°C et thymol Teb =233 °C . L'espèce la plus volatile le m-crésol est récupéré en premier.
Q11. En considérant le m-crésol comme réactif limitant dans la transformation, dont le rendement est de 73 %,
vérifier que le volume de m-crésol nécessaire pour synthétiser 1,0 g de thymol par ce procédé est inférieur à 1 mL.
Quantité de matière de thymol n = 1,0 / M(thymol) =1,0 / 150,2 =6,66 10-3 mol.
Quantité de matière de m-crésol : 6,66 10-3 mol.
Tenir compte du rendement : 6,66 10-3 / 0,73 =8,6 10-3 mol.
Masse de m-crésol : 8,6 10-3 x M(m-crésol) = 8,6 10-3 x108,1 =0,93 g.
Volume de m-crésol = masse / masse volumique du m-crésol = 0,93 / 1,03 ~0,9 mL.
|
...
|
....
|
La phénolphtaléine est un indicateur coloré acide-base adapté pour les titrages d’acide faible. L’objectif de cette
partie est de montrer qu’il en est de même pour le bleu de thymol.
Données :
phénolphtaléine : indicateur coloré acide-base passant de l’incolore au
rose dans la zone de virage expérimentale de pH [8,2 – 9,9] ;
bleu de thymol : indicateur coloré acide-base ayant trois formes participant à deux couples acide-base d’écriture simplifiée BTH2(aq) / BTH–(aq) et BTH–(aq) / BT2–(aq) ;
Pour discuter de l’accord du résultat d’une mesure avec une valeur de référence, on peut utiliser le quotient |x−xref| /u(x) avec x la valeur mesurée, xref la valeur de référence et u(x) l’incertitude-type associée à la valeur mesurée x.
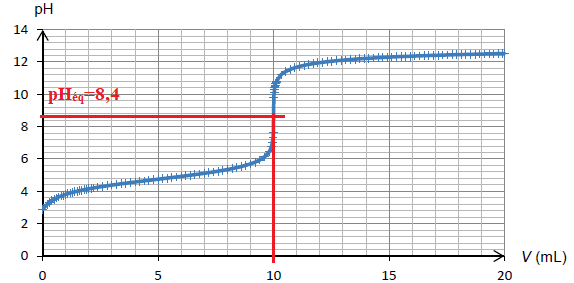
Simulation du titrage de 10,0 mL d'une solution d’un acide faible (acide éthanoïque) de concentration 0,100 mol·L–1 par une solution de base forte (hydroxyde de sodium) de concentration 0,100 mol·L–1.
Q12. Parmi les espèces participant aux couples acide-base du bleu de thymol, identifier la forme amphotère.
BTH–(aq) peut se comporter comme un acide ou comme une base.
Q13. Exprimer la constante d’acidité Ka d’un couple acide-base noté HA / A– en fonction des concentrations des
espèces associées à l’équilibre.
Ka = [A-] [H3O+] / [AH].
Q14. À l’aide de l’ensemble des informations proposées, déterminer la valeur du pKa du couple BTH–(aq) / BT2–(aq)
du bleu de thymol. Justifier que celui-ci puisse remplacer la phénolphtaléine dans nos laboratoires, en précisant le
changement de couleur observé lors du titrage d’un acide faible par une base forte.
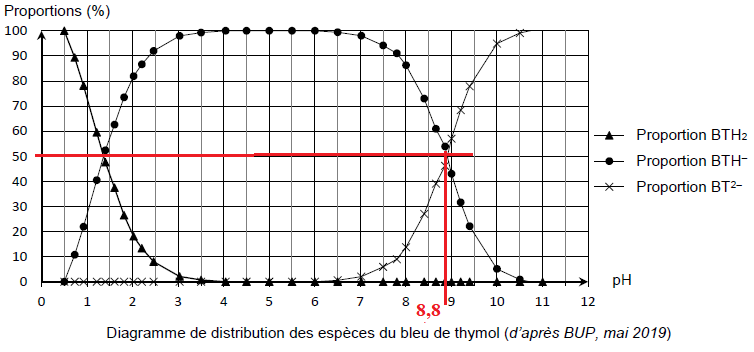
Lorsque [BTH–(aq)] = [BT2–(aq)], alors pH = pKa = 8,8.
Lors du titrage d’un acide faible par une base forte, le pH du point équivalent est voisin de 8,4.
Zone de virage du bleu de thymol : [8,8 -1 ; 8,8 +1] soit [7,8 ; 9,8].
Le pH du point équivalent appartient à la zone de virage du bleu de thymol. Cet indicateur convient.
Lors du titrage d'un acide faible par une base forte, le bleu de thymol
passe de sa forme acide ( jaune) vers sa forme basique (bleu).
Q15. La valeur tabulée du pKa à 25°C du couple acide-base BTH–(aq) / BT2–(aq) est de 8,9. Indiquer si la valeur
expérimentale obtenue est en accord avec celle-ci. L’incertitude-type associée au pKa déterminé par cette méthode
est estimée à u(pKa) = 0,2.
|x−xref| /u(x) =(8,9-8,8 ) / 0,2 = 0,5 < 2, la valeur expérimentale est en accord avec la valeur des tables.
|
ane.
|
|
|