L'arôme
d'ananas,
bac étrangers 2024
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Synthèse du butanoate d'éthyle.
Q1- Nommer les réactifs et donner le nom des fonctions présentes.
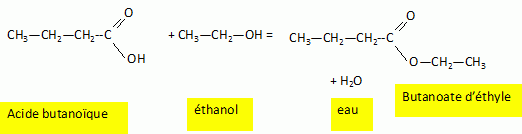 L'éthanol est un alcool primaire.
Q2- Donner le schéma de Lewis de l'acide carboxylique et expliquer pourquoi cette molécule est un acide de Brönsted.
L'éthanol est un alcool primaire.
Q2- Donner le schéma de Lewis de l'acide carboxylique et expliquer pourquoi cette molécule est un acide de Brönsted.
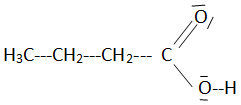
Cette molécule est susceptible de céder un ion H+ : c'est donc un acide de Brönsted.
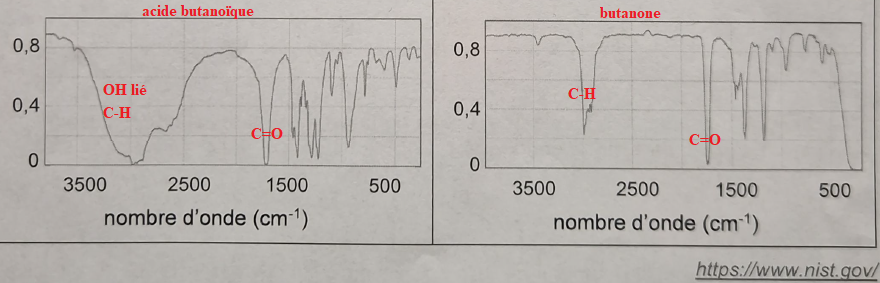
Sur une étagère se trouve deux flacons notés 1 et 2. l'un est de la butanone, l'autre de l'acide butanoïque.
Q3-Identifier les spectres.
Optimisation du rendement .
On
introduit dans un ballon Va = 13,8 mL d'acide butanoïque et Vb =8,8 mL
d'éthanol ( soit 0,15 mol). On chauffe à reflux pendant 30 min. Puis on
isole l'ester.
Q4. Indiquer les précautions à prendre.
L'acide butanoïque est corrosif et l'éthanol est inflammable.
Port de blouse, gants et lunettes ; travailler hors de toutes flamme.
Q5- Donner deux avantages du chauffage à reflux.
La température est un facteur cinétique.
Les vaopeurs se condensent dans le réfrigérant et retombent dans le milieu réactionnel. Il n'y a pas de pertes de matière.
Q6. Montrer que la quantité de matière d'acide butanoïque est n = 0,15 mol.
V = 13,8 mL ; masse volumique : 0,96 g / mL.
m = 13,8 x0,96 =13,25 g.
M =88 g/mol ; n = 13,25 / 88 ~0,15 mol.
Q6. Le mélange réactionnel est-il stoechiométrique ?
Une mol d'éthanol réagit avec une mole d'acide butanoïque.
0,15 mol d'éthanol réagit avec 0,15 mol d'acide butanoïque : le mélange est stoechiométrique.
On obtient 11,7 g d'ester.
Q8. Calculer le rendement de la synthèse.
Quantité de matière théorique d'ester : 0,15 mol.
M(ester) =116 g/mol.
Masse théorique : 116 x 0,15 =17,4 g.
rendement : 11,7 / 17,4 =0,67 (67 %).
Q9.10. Citer deux méthodes permettant d'améliorer le rendement.
Mettre un réactif en excès.
Eliminer l'eau au fur et à mesure de sa formation. Cela n'est pas
possible car l'un des réactifs, l'acool est plus volatil que l'eau
|
...
|
....
|
Suivi cinétique par titrage de l'acide restant.
Synthèse en l'absence d'acide sulfurique concentré.
A t =0, on mélange 13,8 mL d'acide butanoïque et VB = 8,8 mL d'éthanol
dans un ballon thermostaté. On titre l'acide restant à des dates
choisies.
On prélève V = 1,0 mL du mélange réactionnel qu l'onverse dans un
becher ; ce dernier est plongé rapidement dans un bain d'eau glacée.
l'acide restant est titré par de la soude à Cb = 0,50 mol / L.
Q11. Définir l'équivalence.
A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques.
n(acide) = n (base) ; Cb Veq = Ca Va.
12. Compléter la troisième ligne du tableau
t(min)
|
5
|
10
|
15
|
20
|
30
|
45
|
60
|
Veq (mL)
|
7,7
|
6,2
|
5,4
|
4,9
|
4,6
|
4,2
|
4,1
|
n(acide restant) = Cb Veq mmol
|
7,7 x0,5=3,85
|
3,1
|
2,7
|
2,45
|
2,3
|
2,1
|
2,05
|
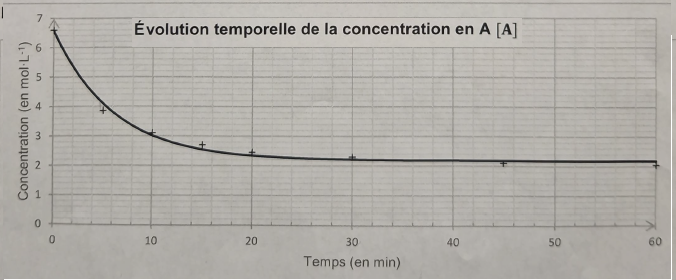
Q13. Définir la vitesse volumique de disparition de l'acide butanoïque.
v = - d[A] /dt. mol L-1 min-1.
Q14. Comment varie cette vitesse au cours du temps.
Cette vitesse correspond à la valeur absolue du coefficient directeur de la tangente à la courbe à la date considérée.
Les tangentes étant de moins en moins inclinées sur l'horizontale, cette vitesse tend vers zéro.
Dans un second temps, on étudie cette synthèse avec les mêmes
conditions initiales mais en ajoutant de l'acide sulfurique concentré.
La variation de volume total du mélange réactionnel reste négligeable.
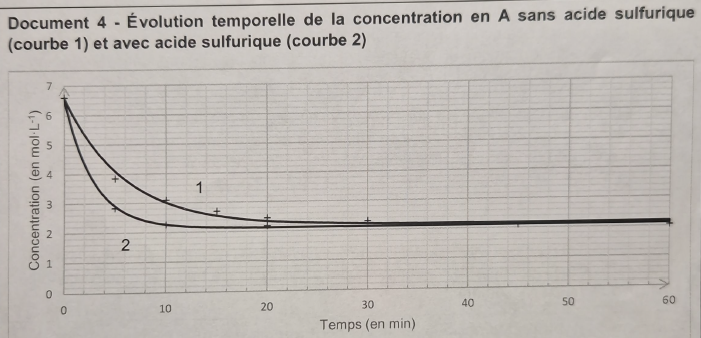
Q15 L'ajout d'acide sulfurique a-t-il permis d'améliorer la cinétique de cette synthèse ?
Courbe 2. A une date donnée, la valeur absolue du coefficient directeur
de la tangente à la courbe est supérieur à celui obtenu pour la courbe
1.
La vitesse de disparition de l'acide butanoïque est donc plus grande : la cinétique est améliorée.
Q16. Identifier le rôle de l'acide sulfurique.
Cet acide joue le rôle de catalyseur.
|
ane.
|
|
|