Ne
jamais mélanger eau de Javel et acide,
bac Asie 2024
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Etude du dégagement de dichlore.
1. Représenter le diagramme de prédominance du couple HClO / ClO-, pKa = 7,5.
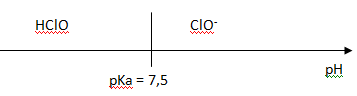
2. Indiquer l'espèce qui prédomine dans l'eau de Javel ( pH =12).
A pH > pKa, la forme ClO- prédomine.
L'étudiant a mélangé 1 L d'eau de Javel avec 1 L d'acide chlorhydrique. Avant le mélange [ClO-] = c0 = 0,40 mol / L. Après mélange, la solution notée Sm a un pH voisin de zéro.
Q3 Justifier que les ions hypochlorite ont été presque tous transformés en acide hypochloreux.
A pH infériieur à pKa, la forme HClO prédomine.
Q4. Ecrire les demi-équations redox des couples suivants :
Cl2 +2e- = 2Cl-.
2HClO +2e- +2H+= Cl2 +2H2O.
Q5. En déduire l'équation de réaction entre les ions chlorure avec l'acide hypochlorure.
2HClO +2e- +2H+= Cl2 +2H2O.
2Cl- = Cl2 +2e- .
Ajouter et simplifier :
2HClO aq+ 2Cl- aq+2H+aq=2Cl2 (g)+2H2O(l).
HClO aq+ Cl- aq+H+aq=Cl2 (g)+H2O(l).
Q6.
L'acide hypochloreux étant le réactif limitant, montrer que la quantité
de matière de dichlore théoriquement produite est 0,40 mol.
n(HClO) =n( Cl2)=0,40 mol
Q7. Calculer le volume théorique de dichlore.
V = n(Cl2 ) x Volume molaire = 0,40 x24 =9,6 L.
Dans la réalité, ce volume est plus faible ; on en recherche la cause.
Etat de conservation de l'acide chlorhydrique.
L'étiquette de la bouteille d'acide chloorhydrique indique : titre massique en acide : 23 %.
masse volumique 1120 g/ L ; masse molaire M = 36,5 g/mol.
Q8. Montrer que la concentration en acide est d'environ 7 mol / L.
Masse de 1 L : 1120 g.
Masse d'acide 1120 x0,23=257,6 g.
Concentration : 257,6 / 35,5 ~7 mol / L.
Pour vérifier cette concentration on titre cet acide par une solution de soude ( Cb=0,020 mol / L)avec suivi pHmétrique.
Q9. Ecrire l'équation support du titrage.
H3O+aq + HO-aq --> 2H2O(l).
La solution d'acide est diluée d'un facteur 500. On titre un volume Vs = 20,0 mL de solution diluée.
Q10. Calculer le volume de solution commerciale à prélever pour prépparer 1 L de solution diluée.
1000 / 500 =2,0 mL.
Q11. Proposer un protocole pour réaliser cette dilution.
Prélever 2,0 mL de solution mère à l'aide d'une pipette jaugée et
verser dans une fiole jaugée de 1 L contenant un tiers d'eau distiléée.
Agiter.Compléter avec de l'eau distillée jusqu'au trait de jauge.
Agiter pour rendre homogène.
Q12. Vérifier que la concentration de la solution d'acide est bien 7 mol / L.
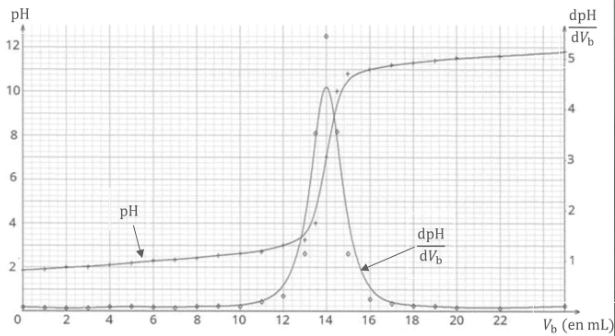
Véq = 14 mL.
A l'équivalence Véq Cb = Cs Vs ; Cs = 14 x0,02 /20=0,014 mol/L.
Tenir compte de la dilution : 0,014 x500 =7 mol / L.
|
...
|
....
|
Conservation de l'eau de Javel.
La bouteille d'eau de javel contient 2,6 % en chlore actif soit une concentration en ion hypochlorite C0 = 0,40 mol / L. La bouteille porte la mention " conserver au frais".
Q13.Définir le temps de demi-réaction et expliquer comment le mesurer dans le cas particulier de la courbe à 30°C.
Le temps de demi-réaction t½ est la durée au bout de laquelle la concentration initiale est divisée par 2.
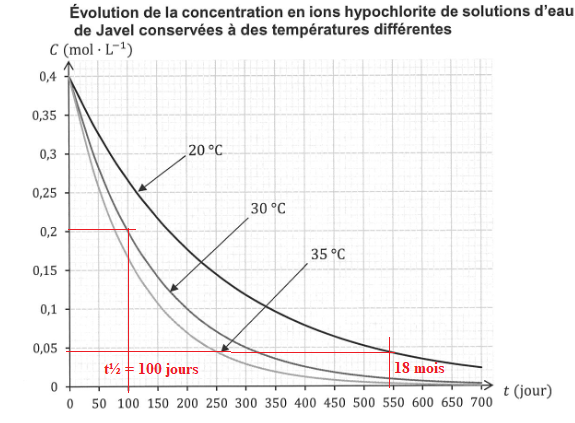
Q14. En utilisant le temps de demi-réaction, caractériser l'influence de la température sur la cinétique de cette transformation.
La température est un facteur cinétique ; quand la température augmente, le temps de demi-réaction diminue.
La mention " conserver au frais" est bien justifiée.
Q15. La bouteille d'eau de Javel utilisée était ouverte depuis 18 mois et conservée à 20°C.
En conséquence la concentration en ion hypochlorite était bien
inférieure à celle indiquée sur l'étiquette. Le volume de
dichlore dégagé était donc inférieur à celui attendu.
|
ane.
|
|
|