L'ammoniac,
un futur carburant pour les transports maritimes,
bac Centres étrangers 2024
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Etude de la molécule d'ammoniac et de ses propriétés.
1. Représenter le schéma de Lewis de cette molécule.
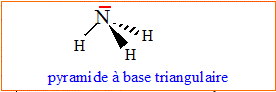
2. Donner un argument justifiant sa grande solubilité dans l'eau.
Comme l'eau, l'ammoniac est une molécule polaire.
On réalise l'expérience du jet d'eau. On remplit de gaz ammoniac un
ballon bien sec. On immerge le tuyau de caoutchouc dans un
cristallisoir contenant de l'eau à pH = 7. On observe alors un jet
d'eau dans le ballon. Une fois le ballon totalement rempli de solution,
on y ajoute du BBT.
3. Définir une base de Brönsted.
Une base est une espèce suceptible de gagner un proton H+.
4. Ecrire l'équation de la réaction de l'ammoniac avec l'eau.
NH3 aq + H2O(l) --> NH4+aq + HO-aq.
5. En déduire la couleur de la solution.
Le BBT est bleu en milieu basique.
On mesure le pH de la solution obtenue : pH = 11,0.
6. Indiquer l'espèce qui prédomine en justifiant.
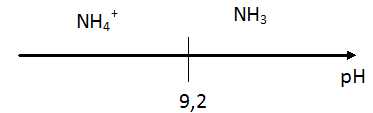
A pH > 9,2, NH3 prédomine.
On simule un titrage d'un volume Vb = 20,0 mL d'une solution aqueuse
d'ammoniac de pH = 11 par de l'acide chlorhydrique de concentration Ca
= 0,100 mol / L.
7. Ecrire l'équation de la réaction support du titrage.
NH3aq + H3O+aq --> NH4+aq + H2O(l).
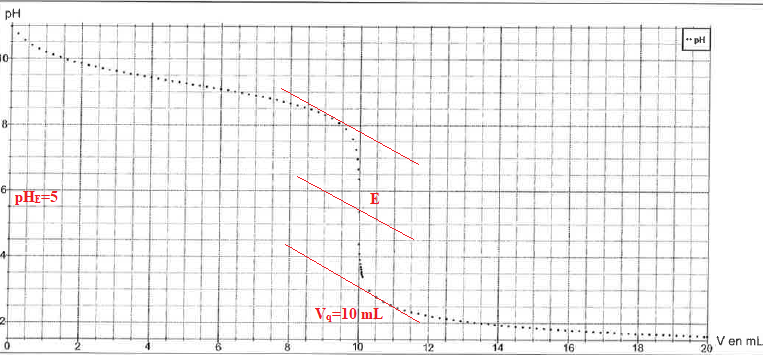
8. Justifier l'utilisation du rouge de méthyle ( zonne de virage 4,2 ; 6,2) comme indicateur coloré.
La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent ( pH = 5 dans ce cas).
9. Déterminer la concentration Cb de la solution d'ammoniac.
A l'équivalence Ca Véq =Cb Vb ; Cb = 0,1 x 10 / 20 = 0,050 mol / L.
|
...
|
....
|
Synthèse de l'ammoniac.
10. Ecrire l'équation de la réaction de synthèse.
N2(g) + 3 H2(g) --> 2NH3(g).
11. En
utilisant 6,0 mol de diazote et 6,0 mol de dihydrogène, on obtient 0,80
mol d'ammoniac. Déterminer l'avancement final de cette réaction.
|
Avancement (mol)
|
N2(g) |
+ 3 H2(g) |
--> 2NH3(g). |
initial
|
0
|
6,0
|
6,0
|
0
|
en cours
|
x
|
6,0-x
|
6,0-3x
|
2x
|
final
|
xmax =2
|
6,0-xmax= 4,0
|
6,0-3xmax =0
|
2xmax=4
|
xf = 0,8 mol. La réaction n'est pas totale.
Rendement : 0,8 / 4 =0,2 ( 20 %).
Production de dihydrogène par électrolyse de l'eau.
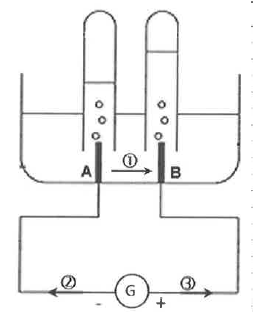
12. Indiquer les deux flèches représentant respectivement le sens du courant et celui du déplacement des électrons.
3 : sens du courant électrique.
2 : sens de déplacement des électrons.
13. Associer à chacune des électrodes A et B une des équations des réactions électrochimiques.
B : anode positive, oxydation : 2H2O(l) --> O2(g) +4H+aq +4e-.
A : cathode négative, réduction 4H+aq +4e---> 2H2(g).
On recueille 4,0 mL de gaz en A et 2,0 mL de gaz en B.
14. Ecrire l'équation de la réaction :
2H2O(l) --> O2(g) +2H2(g).
Le volume de dihydrogène est égal à 2 fois le volume de dioxygène.
La manipulation dure Dt = 3 min 20 s et l'intenité du courant est I = 0,16 A.
15. Calculer la quantité d'électricité Q et en déduire la quantité de matière d'électrons.
Q = I Dt = 0,16 x (3 x60 +20) =32 C.
n(e-) = Q / F = 32 / 96500 =3,3 10-4 mol.
16. En déduire le volume de dihydrogène que l'on peut obtenir.
n(H2 ) =0,5 n(e-)=1,7 10-4 mol.
Vm = 24 L / mol ; volume de dihydrogène =24 x1,7 10-4 ~4 10-3 L = 4 mL, en accord avec l'expérience.
17. Déterminer la masse d'ammoniac qui pourra être produite en 2024 à partir du dihydrogène dans l'usine de Pilbara. Commenter.
640 tonnes de dihydrogène seront produite.
640 106 / M(H2) =3,2 108 mol. de dihydrogène.
n(NH3) = 3,2 108 /1,5 =2,1 108 mol.
Masse d'ammoniac :2,1 108 M(NH3) =2,1 108 x17 =3,6 109 g =3,6 103 tonnes.
Le rendement de la production d'ammoniac est de 20 %.
3,6 106 x 0,2 =7,3 102 t.
|
ane.
|
|
|