Chimie
: oxydoréduction. Prépa médecine.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
1. Pile Zn2+|Zn::
Ag |Ag+.
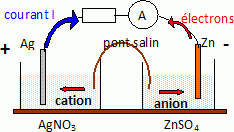 Volume de
chaque compartiment : 0,25 L ; [Ag+] =0,1 mol / L ; [Zn2+]
= 10-4 mol / L.
Volume de
chaque compartiment : 0,25 L ; [Ag+] =0,1 mol / L ; [Zn2+]
= 10-4 mol / L.
E°(Zn2+ / Zn) = -0,76 V ; E°(Ag+/Ag)=0,80 V.
Oxydation du zinc : Zn(s) --> Zn2+aq + 2e-.
Réduction de Ag+ : 2Ag++2e- -->
2Ag(s).
Réaction globale : Zn(s) +2Ag+--> Zn2+aq
+2Ag(s).
Potentiel de
l'électrode d'argent : EAg =0,80 +0,06 log[Ag+] =0,80 + 0,06 log 0,1 =0,74 V.
Potentiel de l'électrode de zinc : EZn =
-0,76 +0,03 log[Zn2+] = -0,76 + 0,03 log 10-4
= -0,88 V.
f.e.m de cette pile : 0,74 +0,88 =1,62 V.
Constante d'équilibre de la réaction globale :
ln K = n FE / (RT) =2 x96500 x1,62 /(8,31 x298)=126 ; K =7 1054.
2.
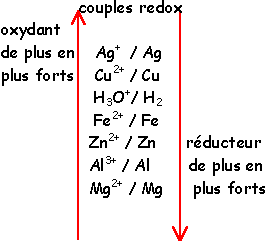
On donne E° (Cd2+/Cd)=-0,40 V ; E° (Zn2+/Zn)=-0,76 V ; E° (Cu2+/Cu)= 0,34 V
; E°
(Ag/Ag)=0,80 V ; E° (Au3+/Au)=1,42 V ;
E° (H+/H2)=0 V.
Le zinc est meilleur réducteur
que l'argent.
Si on plonge du cuivre dans une
solution acide, on n'observe pas de dégagement de dihydrogène.
Si on plonge du zinc dans une
solution acide, on observe un dégagement de dihydrogène.
Dans le couple Cu2+/Cu, Cu2+
est l'oxydant et Cu le réducteur.
3. Oxydation des ions cyanure CN-.
E° (NCO- / CN-)= -0,15 V ; E°( H2O2
/ H2O) = 1,77 V.
CN- +3H2O--> NCO- + 2H3O+ + 2e- oxydation.
H2O2 +2H3O+ +2e---> 4H2O. Réduction
CN-
+H2O2 --> NCO- +H2O.
Constante d'équilibre :
ln K = n FE / (RT) =2 x96500
x(1,77+0,15) /(8,31 x298)~150 ; K ~ 1065.
4. MnO4-
/ Mn2+ et AsO43- / AsO33-.
2 fois {
MnO4- +8H++5e- = Mn2++4H2O
}.
5 fois { AsO33- +H2O= AsO43-+2e- +2H+}.
Ajouter et simplifier :
2MnO4- +16H++10e-+5AsO33- +5H2O = 2Mn2++8H2O
+5AsO43-+10e- +10H+.
2MnO4- +6H+-+5AsO33- = 2Mn2++3H2O
+5AsO43-.
Le nombre d'oxydtion de l'arsenic dans AsO43- vaut : x+4*(-2) = -3 ; x = +V.
5. Alcootest
à usage unique est constitué :
- d'un ballon de matière plastique de volume 1 L muni d'un embout
- d'un tube de verre rempli d'un gel de silice imprégné d'une solution
acide de dichromate de potassium ( K2Cr2O7
).
Le conducteur gonfle totalement le ballon en soufflant dedans puis
adapte celui-ci sur le tube en verre et vide totalement le ballon en
faisant passer l'air à travers le tube.
Si l'air expiré contient de l'éthanol, celui-ci réagit avec les ions
dichromate ( couleur orange ) qui sont réduits en ion chrome (III) (
couleur verte).
Trois minutes après avoir soufflé, on mesure la longueur du changement
de couleur dans le tube actif, sensiblement proportionnelle à la
concentration d'éthanol expiré. Un repère indique le dépassement du
seuil de 0,25 g / L d'air expiré.
3 fois{ C2 H6
O +H2O=
C2H4 O2 + 4
électrons + 4H+}.
Oxydation de l'alcool réducteur.
2 fois{Cr2O72- + 6
electrons +14 H+
= 2 Cr3+ + 7 H2O}. Réduction de l'oxydant, l'ion dichromate.
3 C2 H6 O + 2Cr2O72-
+28 H+ +3H2O---> 3 C2H4 O2 + 4 Cr3+
+ 12 H+ + 14 H2O.
3 C2 H6 O + 2Cr2O72-
+16 H+ ---> 3 C2H4 O2 + 4 Cr3+ + 11 H2O.
Le potentiel du couple Cr2O72- / Cr3+ s'écrit : E
= E°(Cr2O72- / Cr3+)
+0,01 log([Cr2O72-][H+]14 / [Cr3+]2).
E =
E°(Cr2O72- / Cr3+)
+0,01 log[H+]14 +0,01 log([Cr2O72-]
/ [Cr3+]2).
E = E°(Cr2O72- / Cr3+)
-014pH +0,01 log([Cr2O72-] / [Cr3+]2).
Le potentiel du couple C2H4 O2 / C2 H6 O s'écrit :
E = E°(C2H4 O2 / C2 H6 O) +0,06 / 4 log ([C2H4 O2][H+]4 /[C2 H6
O]).
E = E°(C2H4 O2 / C2 H6 O) +0,06 log [H+]+0,06 / 4 log ([C2H4 O2] /[C2 H6
O]).
E = E°(C2H4 O2 / C2 H6 O) -0,06 pH+0,06 / 4 log ([C2H4 O2] /[C2 H6
O]).
Dans l'hypothèse d'une alcoolémie de 0,5 g d'alcool par litre de sang :
quantité d'alcool dans l'air expiré : 0,5 / 2000 ~2,5 10-4
g soit 2,5 10-4 /M(alcool) = 2,5 10-4 / 46~ 5 10-4
mol.
6. Attaque du cuivre plongé dans une
solution contenaant l'ion fer(III).
E°(Cu2+ / Cu)=0,34 V ; E°(Fe3+/Fe2+)=0,77
V..
Cu(s) = Cu2+ + 2e-. Oxydation du
cuivre, le réducteur.
Fe3++e--->Fe2+.
Réduction de l'ion fer (III), l'oxydaant.
Cu(s) +2Fe3+= Cu2+ +2Fe2+.
Constante d'équilibre K = [Cu2+] [Fe2+]2 / [Fe3+]2.
E = 0,77 - 0,34 = 0,43 V.
ln K = nFE / RT = 2 x96500 x0,43 /(8,31 xx298)=33,5 ; K ~ 3 1014.
|
...
|
....
|
7. Les ions du fer FeO42-,
Fe3+.
Le nombre d'oxydation du fer dans FeO42- est : x
+4 *(-2) = -2 ; x = +VI.
Le nombre d'oxydation du fer dans Fe2O3
est : 2 x +3 *(-2) = 0 ; x = +III.
Calcul du potentiel d'un fil de platine plongeant dans une solution pH
=4 contenant les ions Fe3+ et FeO42- :
FeO42- + 8H+ +3e- = Fe3++4H2O.
E = E°( FeO42-/Fe3+ ) +0,02 log ([FeO42-][H+]8
/[Fe3+])=1,9 +0,02 log ([FeO42-][H+]8
/[Fe3+]).
Si FeO42-] =[Fe3+], E = 1,9 +0,02
log(10-4) =1,82 V.
8. Réaction
d'oxydo-réduction du lithium avec l'eau (milieu acide).
Li(s) + H+ = Li+ +½H2(g). K = [Li+]
PH2½ / [H+].
Li(s) =Li+ +e- oxydation du lithium.
E1 = E°(Li+/Li) +0,06 log [Li+] = -3,0 +0,06 log
[Li+]
H+ +e- =½H2(g) réduction de H+.
E2 = E°(H+ / H2(g)) +0,06 log ([H+] /PH2½
)= 0,06 log ([H+] /PH2½ ).
A l'équilibre : -3,0 +0,06 log [Li+] =0,06 log ([H+]
/PH2½ ).
log K =3 / 0,06 =50 ; K = 1050.
9. Couple NO3-/NH4+.
NO3- + 10H++8e- = NH4+
+3H2O. E = E°(NO3- / NH4+)
+0,06 / 8 log([NO3-] [H+]10
/[NH4+]).
E = E°(NO3- / NH4+) +0,06 /
8 log([H+]10) +0,06 /8 log([NO3-]
[H+]10 /[NH4+]).
Potentiel apparent : E°(NO3- / NH4+)
+0,06 / 8 log([H+]10)=E°(NO3-
/ NH4+) + 0,075 log[H+] =E°(NO3-
/ NH4+) -0,075 pH.
10. Solution
contenaant HNO2 (10 mmol/L) et NaNO3 ( 1 mmol /
L) à pH=2.
Potentiel d'une électrode plongeant dans cette solution :
NO3- + 2H+ +2e- = NO2-
+ H2O.
E = E°( NO3-/NO2-) +0,03
log([NO3-][H+]2 /[NO2-])=0,94
+0,03 log(0,012 /10)=0,94 +0,03 *(-5)=0,79 V.
Potentiel standard apparent : E°( NO3-/NO2-)
+0,03 log([H+]2 ) =0,94 -0,06 pH.
|
|