Chimie
: de l'atome aux molécules ; réactions acide base. Prépa médecine.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
1. La liaison
hydrogène.
C'est une action intermoléculaire ou intramoléculaire entre un
atome d'hydrogène et un atome électronégatif comme l'oxygène, l'azote
et le fluor. Elle est plus faible qu'une liaison covalente et plus
forte qu'une liaison de Van der Waals.
A. Est une interaction électrostatique. Faux.
B. Est une liaison faible uniquement intermoléculaire. Faux.
C. Peut s'établir entre une amine tertiaire etune cétone vrai.
D. Peut s'établir entre une amine et un acide carboxylique vrai.
E. Contribue à la stabilisation de la conformation tridimentionnelle
des édiifices moléculaires biologiques vrai.
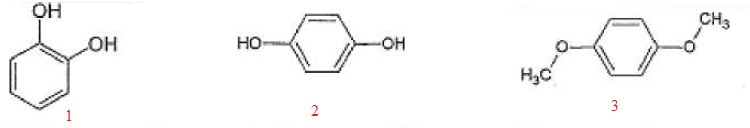
(1) est la seule pouvant établir une liaison hydrogène intramoléculaire.
(1) et (2) peuvent établir des liaisons hydrogène intermoléculaires.
La température d'ébullition est d'autant plus élevée qu'il faut
romptre des liaisons hydrogène intramoléculaires. La température
d'ébullition de (1) est supérieure à celle de (2).
La température d'bullition de l'ester (3) est supérieure à celle de (2).
2.
Schéma de Lewis

3. L'atome de fer 56 26
Fe.
Possède : 26 protons, 56-26=30 neutrons et 23 électrons.
L'atome 57Fe possède un neutron de plus que l'atome 56Fe.
La masse molaire de l'atome 56Fe est 56 u.m.a.
4. L'atome de
scandium 45 21 Sc.
Possède : 21 protons, 45-21=24
neutrons et 21 électrons.
La masse molaire de cet
atome est 45 u.m.a.
Le fluor est l'atome qui a la plus forte électronégativité.
5. Titrage
d'une solution de phénolate par l'acide chlorhydrique.
10 mL d'une solution de phénolate dont le pH vaut 10,9. Phénol / ion
phénolate : pKa = 9,8.
Véqui = 20 mL.
pH = pKa + log ([A - ] /[AH]) ; log ([A- ] /[AH])=
10,9 -9,8 = 1,1 ; [A- ] /[AH] =12,6.
[AH] =[A- ] / 12,6 ~0,08 [A- ]
C =[AH] +[A- ] =1,08 [A- ].
A l'équivalence : 10 [A- ] = 20 CHCl
; [A- ] = 2 CHCl
;
C = 1,08 x2 CHCl
= 2,16 CHCl ;
La concentration initiale en ion phénolate est égale à 1,0 10-2
mol / L.
CHCl = 1,0 10-2 / 2 =5,0 10-3
mol / L.
AH formé réagit avec l'eau en donnant des ion hydronium ; le pH à
l'équivalence est donc inférieur à 7.
6.
Equilibre acido-basique.
La réaction entre CH3COOH avec l'eau est partielle.
CH3COO- est une base faible.
La réaction entre CH3COOH et NH3 est quantitative.
NH3 est une base faible.
CH3COOH (pKa = 4,8)
est un acide plus fort que NH4+(pKa = 9,2).
7. Solution tampon phénol / ion phénolate de pH = 9 à partir d'une solution de phénol de
concentration 0,05 mol / L.
On note AH le phénol et A- sa base conjuguée tels que [AH] +
[A-] =0,010 mol / L.
pH
= pKa + log ([A- ] /[AH]) ; log ([A- ] /[AH])= 9 -9,8 = -0,8 ; [A-
] /[AH] = 10-0,8 ~0,16.
Il faut ajouter de la soude à la solution initiale de phénol.
8. Triméthylamine et acide benzoïque.
(CH3)3N
: C1 = 0,10 mol / L ; (CH3)3NH+
/ (CH3)3N
: pKa1 = 9,9.
pH1 = 7+½pKa1 +½log C1 =7 +½(9,9+log(0,1) =11,45.
C6H5COOH
: C2 = 0,010 mol/ L. C6H5COOH
/ C6H5COO-
: pKa2 = 4,2.
pH2
= ½pKa2 -½log C2 =½(4,2-log(0,01) =3,1.
La
réaction entre l'acide benzoïque et la triméthylamine est quantitative.
( leurs domaines de prédominance sont disjoints).
pH de la solution obtenue après un mélange de deux volumes égaux de ces
deux solutions :
état
|
(CH3)3N |
+C6H5COOH |
-->CH3)3NH+ |
+C6H5COO- |
initial
|
0,10
V
|
0,01
V
|
0
|
0
|
final
|
0,10
V-0,01 V=0,09 V
|
0
|
0,01
V
|
0,01
V.
|
pH
= 7+½ (9,9 + log (0,09)=11,4.
9. Acide
fluorhydrique.
C= 0,1 mol / L ; pH = 2,1.
Cet acide est un acide faible : pH > - log (C).
pH = ½pKa-½log C ; pKa = 2 pH + log C = 4,2 +log 0,1) = 3,2.
On fait réagir une solution notée S2 de soude avec la solution
précédente d'acide fluorhydrique notée S1.
La réaction est quantitative.
Si on ajoute une quantité adaptée de soude à la solution d'acide
fluorhydrique,( titrage avec arrêt à la demi-équivalence), le pH
de cette solution sera égal au pKa de l'acide fluorhydrique.
10. Acide
monochloroacétique (solution notée S) + soude.
ClCH2COOH / ClCH2COO- : pKa = 2,8.
On titre 20,0 mL de S par la soude de concentration Cb = 0,5 mol / L.
Véqui = 8,0 mL.
8,0 x 0,5 = 20,0 CS ; CS= 0,2 mol / L.
A l'équivalence le pH est supérieur à 7.
AH + HO- = A- + H2O. K = [A-] / ([AH ] [HO-]) = [A-][H3O+] / ([AH ] [HO-][H3O+])= Ka / Ke =10-2,8 / 10-14 = 1011,2.
1 L de solution d'acide monochloroacétique est préparée en
dissolvant 0,2 M(ClCH2COOH) =0,2 *94,5 =18,9 g.
11. La L-alanine.
AH2+ /AH± pKa1 = 2 ; AH±/
A- pKa2 =9. Cette seconde acidité sera considérée
comme négligeable.
Solution A : chlorhydrate d'alanine de concentration C = 1 mol / L
notée A.
pH
= ½pKa-½log C = 1.
pH = pKa + log ([AH±] / [AH2+]) ;log ([AH±] / [AH2+])= 1-2=-1 ; [AH±] / [AH2+] =0,1.
[AH±] +[AH2+] = 1 ; 0,1 [AH2+] +[AH2+] = 1 ; [AH2+] =0,91.
On
veut réaliser une solution tampon de pH = 5,5. Le mélange initial doit
être constitué de 50 mL de solution A et de x mL de solution de soude à
1 mol / L.
AH2+ +HO-
-->AH± +H2O.
état
|
avancement
(mmol)
|
AH2+ |
+HO- |
-->AH± |
+H2O |
initial
|
0
|
0,91
x50=45,5
|
xf
|
0,091x50=4,55
|
solvant
|
final
|
xf
|
45,5
-xf
|
0
|
4,55
+xf
|
[AH±]f =(4,55 +xf) /(50 +x) ; [AH2+]f=(45,5 -xf) /(50+x).
[AH±] / [AH2+] =(4,55 +xf) / (45,5 -xf)
pH = pKa + log ([AH±] / [AH2+]) ; 5,5 = 2 +log ([AH±] / [AH2+] ; log ([AH±] / [AH2+])=3,5 ; [AH±] / [AH2+]~3,2 103.
3,2 103(45,5 -xf) =4,55 +xf ; xf ~45,48 mmol.
Il faut ajouter environ 45 mL de soude à 1 mol / L.
12. H2S / HS- .
- Solution de
sulfure de sodium Na2S à 0,1 mol / L : pH = 12,75.
pH d'une solution de base faible S2-: pH = 7 +½pKa2 +½log C
; pKa2 = (12,75 x 2-14 -log(0,1))=12,5.
- Solution NaHS à
0,1 mol / L ; pH = 10.
pH =½ pKa1 +½pKa2 ; pKa1 = 20 -log 12,5 = 7,5.
- On mélange 1 L de solution de sulfure de sodium Na2S
à 0,1 mol / L et 3 L de solution de sulfure d'hydrogène à 0,1 mol / L.
Calcul de la concentration de l'ion HS-.
S2- + H2S --> 2HS-.
H2S est en large excès ; n(S2-) = 0,1 mol ; n(HS-) =0,2 mol
dans 4 L ; [HS-]=0,2 / 4
=0,05 mol / L.
pH
de cette solution : [H2S] =0,2 / 4 =0,05 mol / L.
pH = pKa1 =7,5.
13. Titrage
50 mL acide benzoïque (pKa = 4,2) par la soude à 0,050 mol/ L.
- pH de la
solution de soude ( base forte) : 14 + log C = 14 + log (0,05) =15,7..
- On verse 10 mL de
soude ; pH du milieu réactionnel est égal à 4,2. ( demi équivalence du
titrage).
A l'équivalence : 0,05 x 20 = 50 C ; C = 0,02 mol / L.
M(acide benzoïque) = 122 g / mol. Titre massique de l'acide benzoïque =
0,02 * 122 =2,44 g / L.
-
pH de la solution à l'équivalence = pH d'une solution de base faible.
pH = 7 +½pKa + ½log( Ca Va /(Va+Vb)) = 7+2,1 +0,5 log(0,02 x50
/(50+20)) =9,1 -0,9 =8,2.
14. Acide ascorbique.
pKa1 =4,17 ; pKa2 = 11,57.
Solution 1
: un comprimé de vitamine C est dissous dans 100 mL d'eau. Le pH de la
solution est 2,86.
pH d'une solution d'acide faible : ½pKa1 -½log C ; 2,86 = 2,08
-½log C ; log C = -1,55 ; C = 0,028 mol/ L soit 0,0028 mol dans 100 mL.
M(acide ascorbique) =176 g / mol. masse d'acide ascorbique dans le
comprimé : 0,0028 x 176 =0,496 g.
On ajoute à cette solution un volume V b de soude
à C b=0,055 mol / L afin de neutraliser la première acidité.
A l'équivalence V bC b = 100 x 0,0028 ; V b
= 5,1 mL.
A l'équivalence on a une solution contenant l'ion AH -(
ampholyte) tel que C = 0,0028 /(0,1051)=0,0266 mol / L.
pH de la solution à
l'équivalence ½(pKa1 +pKa2) =(4,17 +11,57) / 2 =7,87.
Forme tamponnée de la vitamine C ; le comprimé de 500 mg contient de
l'acide ascorbique et de l'ascorbate de sodium. le pH de la solution
obtenue après dissolution de ce comprimé dans 100 mL d'eau est 4,47.
pH = pKa1 + log([AH-] / [AH2]) ; log([AH-] / [AH2])
= 4,47 -4,17 =0,3 ; [AH-] / [AH2]=2.
[AH-] = 2 [AH2]
;
[AH-] = n(ascorbate)
/ 0,1 = 10 x m(ascorbate) / M(ascorbate de sodium) = 10x m(ascorbate) /
198 =0,05 x m(ascorbate).
m(AH2 ) = 0,5-m(ascorbate) ; [AH2] = (0,5-m(ascorbate)) / (0,1 M(AH2) =(0,5-m(ascorbate)) / 17,6.
0,05 x m(ascorbate) = 2 (0,5-m(ascorbate)) / 17,6.
0,05 x m(ascorbate) +2 / 17,6 m(ascorbate) =1/17,6 ; m(ascorbate) =0,347 g= 347 mg.
|
...
|
....
|
15. Préparation d'une solution tampon de pH
= 7,4.
A partir d'une solution aqueuse d'acide orthophosphorique H3PO4
contenant 0,04 mol de cet acide, en ajoutant une solution de
soude à 0,8 mol / L.
pKa de cet acide : 2,1 ; 7,1 ; 12,4.
A pH = 7,4, HPO42- est majoritaire.
A la première équivalence, H2PO4- est
majoritaire.
A la
première équivalence on a une solution contenant l'ion H2PO4-( ampholyte).
pH = ½(pKa1 +pKa2)=(2,1 +7,1) / 2
=4,6.
A la première équivalence : Ca Va = Cb Vb ; 0,04 = 0,8 Vb ; Vb =0,05 L
= 50 mL.
Volume de soude à ajouter pour obtenir le tampon à pH = 7,4.
H3PO4 +HO-
--> H2PO4- +H2O. Vb =50 mL.
H2PO4- +HO-
-->HPO42- + H2O.
pH = pKa2 + log([HPO42-] / [H2PO4-]) ; log([HPO42-] / [H2PO4-]) =7,4-7,1=0,3 ; [HPO42-] / [H2PO4-] = 100,3 = 2.
[HPO42-] = 2 [H2PO4-]
état
|
avancement
(mol)
|
H2PO4- |
+HO-
|
-->
HPO42- |
+ H2O |
initial
|
0
|
0,04
|
|
0
|
solvant
|
en
cours
|
x
|
0,04-x
|
|
x
|
fin
|
xf
|
0,04-xf
|
|
xf
=2(0,04-xf) |
|
3xf = 0,08 ; xf
= 0,08 /3~0,027 mol.
Il faudra donc 50 x2/3 ~33 mL de soude ; 50 +33 = 83 mL de soude.
16. Propriétés
acido-basique de l'eau oxygénée à 2 mol / L.
H2O2 aq --> HO2-aq +H+aq.
pKa = 12.
Le pH de cette solution est : pH = ½pKa-½log C = 6 -0,5 log 2 ~5,8.
Le nombre d'oxydation de l'oxygène dans H2O2 est
(-I).
On plonge une lame de platine dans une solution d'eau oxygénée à 0,1
mol / L dans laquelle on fait barboter du dioxygène à pH = 6 sous une
pression de 104 Pa.
O2(g) +2H++2e- = H2O2 aq.
Potentiel pris par la leme de platine :
E = E°(O2/H2O2)+0,03
log (P(O2) [H+]2 / [H2O2]) =0,68 +0,03 log (104
x10-12 /0,1) =0,68 +0,03 log (10-7) =0,68-0,21
=0,47 V.
17. Préparation d'une solution tampon de pH =
8,5.
Il faut utiliser des espèces dont le pKa s'approche au mieux du pH
souhaité.
NH4+/NH3 pKa = 9,25 ; C4H12NO3+/
C4H11NO3 pKa = 8,3.
18. La glycine.
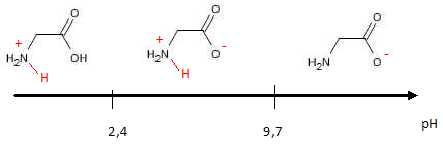
Réaction globale de
dissociation de la glycine : AH2+=
A-
+2H+.
- Ka1 = [AH±][H+]
/[AH2+]
; Ka2 =[A-][H+]
/
[AH±]
; Ka1
Ka2
=
[H+]2[A-]
/ [AH2+]
AH2+=
A- +2H+. K = [H+]2[A-]
/ [AH2+]=
Ka1
Ka2
.
- pH d'une solution
de AH±
( ampholyte) de concentration 0,1 mol / L.
pH = ½pKa1 +½pKa2 =(2,4 +9,7) / 2 ~ 6.
- Calcul
du pKa de la réaction globale de dissociation de la glycine.
K
= [H+]2[A-]
/ [AH2+]
; log K = 2 log [H+]
+ log( [A-]
/ [AH2+])
-log
K = -2 log [H+]
- log( [A-]
/ [AH2+]).
pH = pKa -
log( [A-]
/ [AH2+]).
18. Solutions de nitrite
de sodium et de chlorure d'ammonium.
- pH d'une solution
de nitrite de sodium à 0,01 mol /L. HNO2 / NO2-
pKa = 3,4.
pH d'une solution de base faible : 7 +½pKa+½log C = 7 +1,7 +½log
0,01 = 7,7.
- pH d'une
solution de chlorure d'ammonium à 0,05 mol / L.NH4+
/ NH3 pKa = 9,2.
pH d'une solution de base faible : ½pKa -½log C = 4,6-½log 0,05
=4,6 +0,65 = 5,25.
Pour cette solution, Ka est relié au coefficient de dissociation a de NH4Cl par :
NH4+ + H2O = NH3 + H3O+.
[NH3]
=[
H3O+]=a
[NH4+]0
; [NH4+]
+
[NH3]=[NH4+]0
;
[NH4+]
=
[NH4+]0
-a[NH4+]0
=
(1-a)[NH4+]0
.
Ka
= [NH3][
H3O+]
/
[NH4+]
=a2 [NH4+]0/(1-a).
- pH d'une solution
constituée de 20 mL de NH4Cl à 0,05 mol / L et de 100 mL de
NaNO2 à 0,01 mol / L.
NH4+
+NO2-
-->NH3
+ HNO2.
Le mélange initial est équimolaire. pH = ½(9,2 +3,4) =6,3.
19. Acide carbonique.
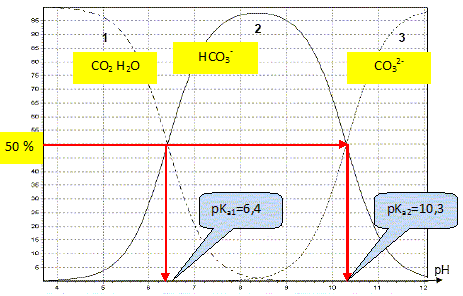
Somme des deux pKa : 6,4 +10,3 = 16,9.
- pH d'une solution
de NaHCO3 à 0,1 mol / L :
pH d'une solution d'un ampholyte HCO3- : ½( pKa1
+pKa2) =8,45.
- A pH = 5,
expression du pH de cette solution d'acide carbonique.
CO2, H2O est majoritaire ; pH d'une solution
d'acide faible :
pH = ½pKa1 - log C.
20. Solution NaCN à
0,1 mol/L. HCN / CN- pKa = 9,2.
pH d'une solution de base faible pH = 7 +½pKa + ½ log C = 7 +4,6+0,5
log 0,1 =11,1.
A pH > pKa, CN- prédomine.
-log [H3O+] =½(-log(Ke) -log Ka +log C) =½ log(C
/(KeKa)).
log [H3O+]
=½.log (KeKa
/ C) = log [KeKa / C]½ ; [H3O+] =[KeKa / C]½ .
21. Solution aqueuse
(notée 1) constituée d'acide lactique (25 mmol) et de lactate de sodium
( 75 mmol). pKa (HA / A-) =3,9.
On y ajoute 50 mmol de HCl sans variation notable de volume et on
obtient la solution 2..
- pH de la solution 1 :
pH = pKa + log ( [base] / [acide conjugué] )=3,9 + log (25 / 75) = 3,9
+log(1/3) =3,4.
- pH de la solution
2 :
A- +H3O+
=AH + H2O. Il se forme 50 mmol de HA ( total 100 mmol) ; il
reste 25 mmol de A-.
pH = pKa + log ( [base] /
[acide conjugué] )=3,9 + log (25 / 100) = 3,9 +log(1/4) =3,3.
C'est une solution tampon.
|
|



