Estérification, pile, dipôle RC, RLC,
Bac sciences Tunisie 2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Chimie. Estérification.
1. 2. Nommer la réaction entre l'acide A et l'alcool B qui conduit à l'acétate d'éthyle. Ecrire cette réaction.
Réaction d'estérification entre l'acide éthanoïque et l'éthanol.
CH3-COOH + CH3-CH2OH = CH3-COO-CH2-CH3 + H2O.
3. Pourquoi place t-on initialement l'erlenmeyer dans un bain d'eau glacée ?
En plaçant l'erlenmeyer initialement dans un bain d'eau glacée, on réalise un blocage cinétique.
4. Quel est le rôle de l'acide sulfurique ?
L'acide sulfurique joue le rôle de catalyseur.
5. Vérifier que le mélange initial est équimolaire.
Ethanol : masse (g) = volume (mL) x masse volumique ( g / mL) =10,5 x0,79 =8,285 g.
Masse molaire : 2x12 +6+16 =46 g/mol.
Quantité de matière : 8,285 / 46 =0,18 mol.
Acide éthanoïque : masse(g) = 10,3 x1,05 = 10,815 g.
Masse molaire : 2 x12 +4 +2x16 = 60 g/mol.
Quantité de matière : 10,815 / 60 =0,18 mol.
Volume total VA + VB = 20,8 mL.
Quantité de matière des réactifs dans chaque tube : n0=0,18 x2 /20,8 ~0,0173 mol.
6. Indiquer pourquoi chaque tube à essais est équipé d'un réfrigérant à air.
Dans le réfrigérant à air les éventuelles vapeurs des réactifs et
produits se condensent et retombent dans le tube : il n'y a pas de
perte de matière.
Tube n°
|
1
|
2
|
3
|
4
|
5
|
t(min)
|
0
|
20
|
40
|
60
|
80
|
VE(mL)
|
17,5
|
10,1
|
7,3
|
6,0
|
6,0
|
7. Indiquer la différence entre n0 et celle de CVE.
Dans le tube n°1, quantité de matière de soude à l'équivalence : C VE = 1 x17,5 = 17,5 mmol.
La soude titre l'acide éthanoïque et l'acide sulfurique.
8. Montrer que l'avancement x s'écrit x = C(VE0-VE).
L'avancement de la réaction est égal à la quantité de matière d'ester
formé, c'est à dire à la quantité de matière initiale d'acide
éthanoïque (CVE0) diminuée de la quantité de matière d'acide éthanoîque restant ( CVE).
x = C(VE0-VE).
9. Déterminer le taux d'avancement final. En déduire une propriété de la réaction.
Le taux d'avancement final est égal à la proportion d'acide éthanoïque ayant réagi à la fin de la réaction.
Quantité de matière d'acide restant à t = 60 min : CVE =1 x6,0 = 6,0 mmol.
Quantité de matière initiale d'acide éthanoïque : 17,3 mmol.
Taux d'avancement final :(17,3-6) / 17,3 ~0,65 (65 %).
La réaction d'estérification est limitée par l'hydrolyse de l'ester.
10. Dégager une autre propriété de la réaction.
La réaction est lente, l'équilibre chimique est atteint au bout d'une heure.
11. Ecrire la réaction entre l'éthanol et un dérivé de l'acide éthanoïque.
En remplaçant l'acide éthanoïque par le chlorure d'éthanoyle, l'estérification est rapide et totale.
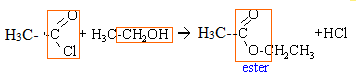
Pile cobalt / nickel.
1. Donner le symbole d'une pile.
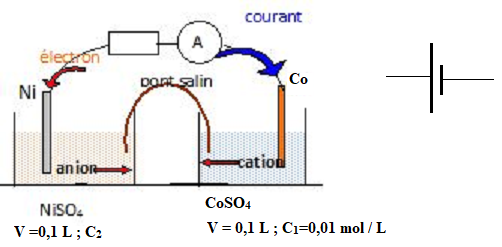
2. Calculer la fem standard de cette pile.
Co+Ni2+ = Co2+ + Ni. K =4,64.
Fem E de cette pile à 25°C ( 298 K) :
z E F = RT ln K.
z = 2 électrons échangés ; F = 96500 C : R = 8,3, constante des gaz parfaits.
E = 8,3 x298 ln(4,64) / (2x96 500) ~0,020 V.
3. Comparer le pouvoir réducteur des deux couples.
A l'anode le cobalt s'oxyde selon Co --> Co2+ +2e-.
Le cobalt est plus réducteur que le nickel. Le cobalt est la borne négative de la pile.
L'ion nickel se réduit à la cathode : Ni2++2e- --> Ni.
Le nickel est l'oxydant le plus fort, il se réduit. Le nickel est la borne positive de la pile.
4. Calculer C2.
On intègre cette pile dans un circuit série comprenant un résistor, un interrupteur et un ampèremètre.
Lorsque la pile est usée ( date t2), l'avancement volumique est égal à 0,080 mol / L.
Potentiel standard du couple Ni2+ / Ni : -0,26 V.
Potentiel standard du couple Co2+ / Co : -0,29 V.
Potentiel de l'électrode de cobalt : E1 = -0,29 +0,03 log([Co2+]).
Potentiel de l'électrode de nickel : E2 = -0,26 +0,03 log([Ni2+]).
A la date t2 : E2 -E1 =0 ; -0,26 +0,03 log([Ni2+]) = -0,29 +0,03 log([Co2+]).
log([Ni2+]) - log([Co2+])=-0,03 / 0,03 = -1.
log([Ni2+] /[Co2+] ) = -1 ; [Ni2+] /[Co2+]= 0,1.
[Ni2+]=C2-0,08 ; [Co2+] =0,01 +0,08 = 0,09.
C2-0,08=0,09 ; C2 =0,17 mol / L.
On ouvre alors l'interrupteur et on ajoute un volume Ve l'eau distilée dans l'un des béchers. La fem de cette nouvelle pile est égale à -9 mV.
5. Déterminer Ve.
Le nickel constitue cette fois la borne négative de la pile.
Ni --> N2+ + 2e-..
Potentiel de l'électrode de cobalt : E1 = -0,29 +0,03 log([Co2+])= -0,29 +0,03 log(0,09)= -0,291 V.
Potentiel de l'électrode de nickel : E2 = -0,26 +0,03 log([Ni2+]).
-0,291 -(-0,26 +0,03 log([Ni2+]) = -0,009.
-0,0224 -0,03log([Ni2+])=-0,009.
-0,0134 = 0,03log([Ni2+]) ; log([Ni2+])=-0,446.
[Ni2+]=0,356 mol / L.
0,356 = 0,09 / (0,1 +Ve).
0,1 + Ve = 0,356 / 0,09 ~3,96.
Ve =3,86 L.
On a ajouter de l'eau dans le becher contenant le sulfate de nickel.
|
...
|
....
|
Physique.
Dipôle RC.
Il est monté en série avec un condensateur de capacité C, un résistor R = 40 ohms et un interrupteur K.
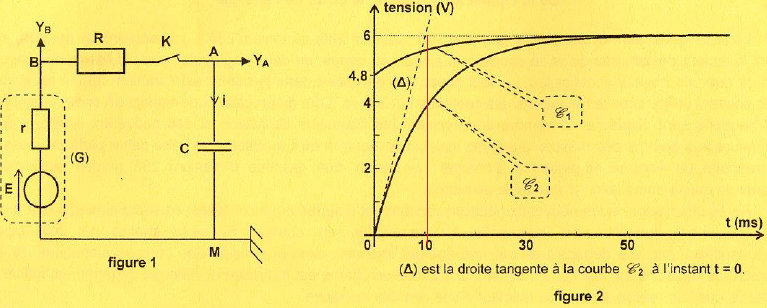
1. Etablir l'équation différentielle régissant la tension uC(t) =uAM(t).
Loi des mailles : E-ri = Ri +uC.
i = dq /dt ; q = CuC ; i = C duC/dt.
E = (R+r) C duC/dt +uc.
On pose t = 1 /((R+r)C).
duC/dt +uc / t = E / t.
2. Identifier la courbe correspondant à uAM(t). En déduire E.
Le condensateur est initialement déchargé, donc uC(t=0) = 0 ( courbe C2).
Lorsque le condensateur est chargé ( i =0) et uC =E = 6 V.
3. Exprimer uBM(t=0).
uBM(t=0) =E-ri(t=0) =Ri(t=0).
i(t=0)= E/ (R+r).
uBM(t=0) =E-rE/ (R+r) = RE /(R+r).
4. Déterminer r et la constante de temps du circuit.
4,8 = 40 x6 /(40+r) ; 40+r = 40 x6 /4,8 =50 ; r = 10 ohms.
Constante de temps (abscisse de l'intersection de l'asymptote et de la tangente à l'origine courbe C2) = 10 ms= 0,01 s..
1 /((R+r)C) = 0,01.
C = 0,01 x50 C =2 F.
Dipôle RLC.
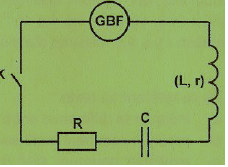
R = 30 ohms. Valeur efficace de la tension délivrée par le GBF : U = 8 V.
Expérience 1. Fréquence du GBF : N = 90 Hz.
UR = 4,2 V ; UBobine = 8,4 V.
1. Qialifier le type d'oscillations.
Le GBF impose la fréquence : les oscillations du courant ne sont pas libres mais forcées.
2. Déterminer la valeur efficace de l'intensité efficace du couranr.
Intensité efficace du courant traversant le circuit :
Ieff = UR / R = 4,2 / 30 =0,14 A.
3. Préciser le caractère capacitif, inductif du circuit
L'intensité est en avance sur la tension : le circuit est donc inductif.
4. Compléter la figure suivante et en déduire r, L et C.
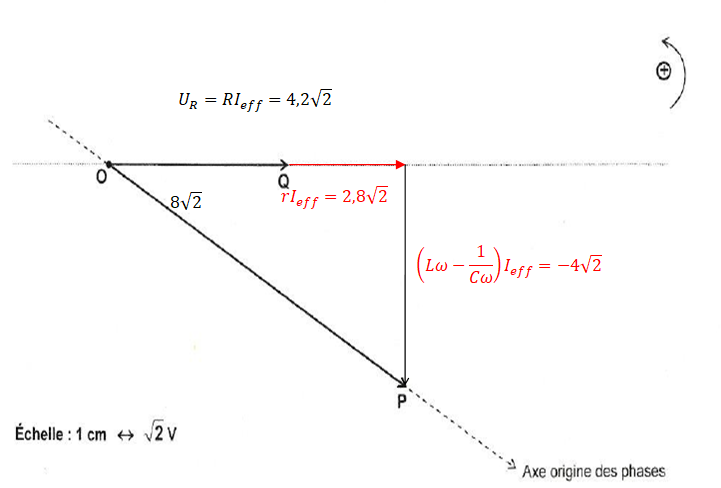
r = 2,8 x2½ / Ieff =2,8 x2½ / 0,14 ~5,6 ohms.
Pulsation : w =2 p N = 2 x3,14 x90=565,5 rad/s.
LwIeff + rIeff =8,4 ; LwIeff =8,4 -28,3 x0,14 x2½ =2,8 V.
L = 2,8 / (535,5 x0,14)~0,037 H.
Ieff/(Cw) =2,8+4 x2½ =8,46.
Cw =0,14 / 8,46 =0,0165 ; w =0,0165 / 565,5 =2,9 10-5 F.
Expérience 2. La fréqquence du GBF varie.
On observe un phénomène de résonance ( tension maximale aux bornes du condensateur pour une valeur N2 de la fréquence).
LCw2=1.
w2=1 /(0,037 x2,9 10-5) =9,3 105 ; w =965 rad/s : N = 965 /(2 x 3,14) ~154 Hz. ( fréquence propre du circuit RLC).
C'est à cette fréqquence qu'oscille le système s'il est livré à lui même.
Dans le cas d'oscillations forcées :
Cas 1. Si on mesure la fonction de transfert UR / tension d'entrée Ue, le maximum de la fonction de transfert est toujours à la fréquence propre.
Cas 2 : on mesure la fonction de transfert Ubobine
/ Ue. Le maximum de la fonction de transfert est déplacé vers les
hautes fréquences. Si on augmente R, la fréquence de résonance croït.
La fréquence de résonance est toujours supérieure à la fréquence propre.
Cas 3 : on mesure la fonction de transfert UC
/ Ue. La fréquence de résonance baisse lorsque R augmente. La fréquence
de résonance est toujours inférieure à la fréquence propre.
Radioactivité.
1. Indiquer la différence entre un noyau fertile et un noyau fissile.
Les noyaux fissiles sont susceptibles de subir une fission quelque soit l'énergie des neutrons qui les percutent.
Les noyaux fertiles ne sont fissibles qu'au contact d'un neutron ayant une énergie suffisante.
2. Comment maitrise t-on la réaction de fission dans le réacteur d'une centrale ?
On maitrise la réaction de fission au sein d'un réacteur nucléaire en
capturant une grande partie des neutrons pour maintenir un rythme de
fission constant. Seul un neutron issu d'une fission provoque une
nouvelle fission.
3. Indiuer pourquoi le thorium 232 et l'uranium 238 sont toujours présents sur terre aujoird'hui ?
Le thorium 232 et l'uranium 238 possèdent des périodes radioactives de l'ordre de 1010 ans.
Ils sont donc toujours présents sur terre ( âge de la terre : 4,5 milliards d'années).
4. Déterminer x dans la réaction suivante.
23592U + 10n ---> 9438Sr + 14054Xe + x 10n.
Conservation du nombre de nucléons : 235 +1 = 94 +140 +x ; x = 2.
5. Déterminer l'énergie libérée par la fission d'un noyau d'uranium 235.
Energie libérée par la fission d'un noyau d'uranium 235 :
m(94Sr) +m(140Xe) +m(neutron) -m(235U) =93,89446+139,88909 +1,0087 -234,99232=-0,20007 u.
-0,20007 x 1,660 10-27 =-3,32 10-28 kg.
Cette diminution de masse s'acompagne de la libération d'énergie dans le milieu extérieur ( ce que traduit le signe négatif) :
Dmc2 = -3,32 1028 x( 3 108)2=-2,99 10-11 J.
6. Vérifier que la fission d'un gramme d'uranium 235 produit plus d'énergie que la combustion d'une tonne de pétrole.
Une mole d'uranium 235 contient NA = 6,02 1023 noyaux d'uranium 235.
Energie libérée par la fission d'une mole d'uranium 235 :
2,99 10-11 *6,02 1023 =1,8 1013 J = 1,8 104 GJ.
1 tep (tonne équivalent pétrole)= 42 GJ
1,8 104 /42 = 456 ~ 4,3 102 tep.
|
|
|
|