Exercice 1. Partie A :
L’hydrogénocarbonate de sodium, connu aussi sous l’appellation
bicarbonate de soude, est un
composé minéral de formule NaHCO
3 aux multiples usages.
Soluble dans l’eau, il se décompose en deux
espèces ioniques : l’ion sodium Na
+ et l’ion
hydrogénocarbonate HCO
3-
.
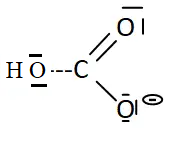
I-1- Donner
le schéma de Lewis de l’ion hydrogénocarbonate.
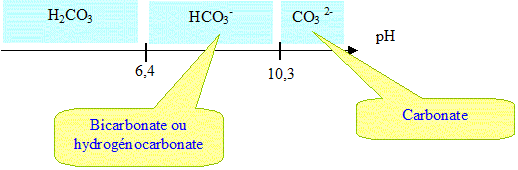
L’ion hydrogénocarbonate est impliqué dans deux couples acidobasiques :
HCO
3- / CO
32- de pKa1 =
10,3 et H
2CO
3 / HCO
3- de
pKa2 = 6,4
I-2- Quel terme
permet de qualifier une telle espèce qui peut jouer le
rôle d’un acide ou d’une base ?
Amphotère.
I-3- Indiquer les espèces
chimiques dominantes en fonction du pH
(diagramme de prédominance).
 Partie B :
Partie B : On dispose
d’une solution aqueuse
d’hydrogénocarbonate de sodium
commerciale dont on veut vérifier la
concentration.
On se propose de doser un échantillon de
volume V
1 = 50,0 mL par une solution d’acide
chlorhydrique (monoacide fort) de
concentration 2,0⨯10
-1 mol.L
-1 selon la
réaction : HCO
3- + H
3O
+
--> H
2CO
3 + H
2O.
On suit la valeur du pH en fonction du volume
de la solution d’acide ajouté comme le
montre la courbe de dosage ci-dessous.
I-4- Calculer le pH
de la solution titrante d’acide chlorhydrique.
pH = -log (c) = -log (0,20) ~0,7.
I-5- La concentration
massique indiquée sur le flacon commercial de la
solution
d’hydrogénocarbonate de sodium à titrer est : 16 g.L
-1,
déterminer la
concentration molaire
correspondante.
16 / M(NaHCO
3) = 16 / 84=0,19 mol / L.
I-6- D’après la courbe de
dosage pH = f(VHCl aq), mesurer le volume
équivalent puis en déduire
concentration réelle de la solution d’hydrogénocarbonate de sodium.
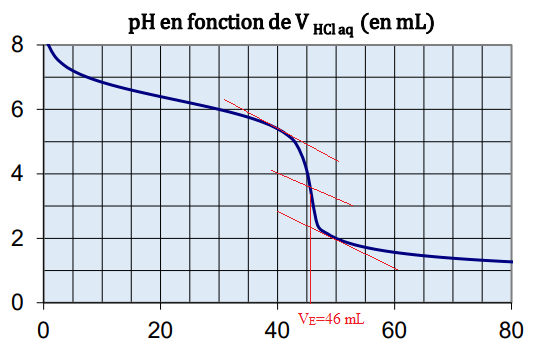
C V
1 = [HCl] V
E ; C =0,20 x46 / 50 ~0,18 mol / L.
Partie C :
L’hydrogénocarbonate de sodium se décompose sous l’effet de
la chaleur pour donner du
carbonate de sodium, du dioxyde de carbone (gaz) et de l’eau (gaz)
selon l’équation-bilan :
2 NaHCO
3 solide --> Na
2CO
3 solide +
CO
2 gaz + H
2O gaz.
On chauffe un échantillon de 0,050 mol d’hydrogénocarbonate de
sodium
jusqu’à obtenir une masse
constante de solide blanc.
I-7-
Déterminer le volume de gaz dégagé lors de l’expérience.
n(CO
2) + n(H
2O) = n = 0,050 mol.
Volume molaire des gaz : 24 L/mol.
V = 0,050 x24 =1,2 L.
I-8-
Déterminer la masse finale de produit solide à l’issue du
traitement thermique
n(Na2CO3) =0,5 n = 0,025 mol.
M(Na2CO3) =106 g /mol.
m = 0,025 x106=2,65 g.
Exercice 2.
L’électrification du parc automobile mondial à l’horizon 2050 devrait entraîner une multiplication par 4 de
la demande de nickel entrant dans la fabrication des batteries. On se propose ici d’analyser un cristal de
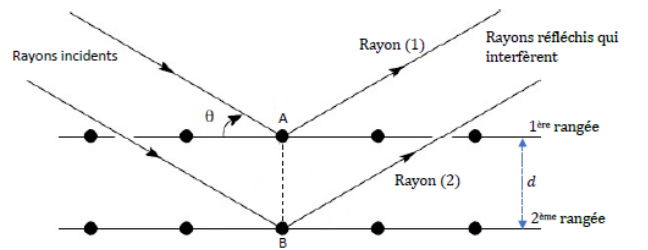
nickel en déterminant la distance entre les plans d’atomes. Pour simplifier, on considère deux rangées
d’atomes séparées par du vide et éloignées l’une de l’autre d’une distance d (voir figure ). Lorsqu’on
envoie une onde de longueur d’onde
l = 0,154 nm sur le cristal, les rayons réfléchis par les atomes
interfèrent. Ici, on ne considère que les ondes qui vont interférer avec l’atome situé au point A d’une
première rangée et l’atome situé au point B d’une deuxième rangée (voir figure). Les rayons incidents
sont parallèles entre eux et forment un angle
q avec les rangées d’atomes. Après avoir été réfléchis par les
atomes, ils repartent parallèles entre eux et forment à nouveau le même angle
q avec les rangées. Les ondes
réfléchies vont alors interférer entre elles pour une valeur particulière de cet angle
q.
 II-1-
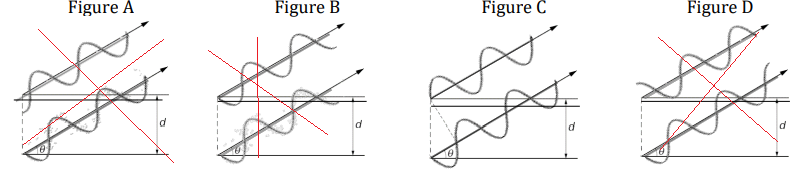
II-1- Afin que les interférences soient constructives, comment doivent vibrer les ondes correspondant
aux rayons (1) et (2) ?
Les ondes doivent être en phase ou décalées d'un nombre entier de longueur d'onde..
II-2- Afin d’illustrer la question précédente, choisir la situation correspondant à des interférences
constructives.
 II-3-
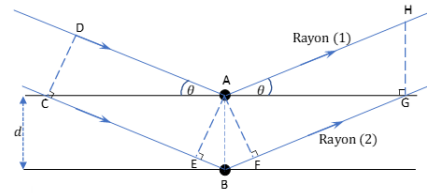
II-3- Donner l’expression de la différence de chemin optique
d à partir des longueurs des segments
pertinents entre les points de la figure 2 ci-dessous.
 II-4-
II-4- Cocher la réponse donnant l’expression de la différence de chemin optique
d = 2 EB =2 d sin q.
II-5- Quelle relation doit-il y avoir entre le chemin optique et la longueur d’onde pour que les
interférences soient constructives ?
d = k
l avec k entier naturel.
II-6- On obtient des interférences constructives pour un angle
q = 25,9°. Dans le cas où la valeur de
d
est la plus petite, calculer la valeur de d .
2 d sin q = l ; d = l / (2 sinq) =0,154 10-9 /(2 sin25,9)=1,76 10-10 m.
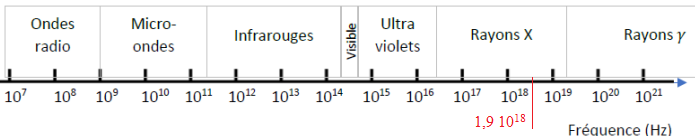
II-7- Le tableau ci-dessous représente le spectre en fréquence des ondes électromagnétiques.
Montrer que l’onde utilisée appartient au domaine spectral des rayons X.
f = c /
l = 3,0 10
8 / (
0,154 10-9) =1,9 10
18 Hz.