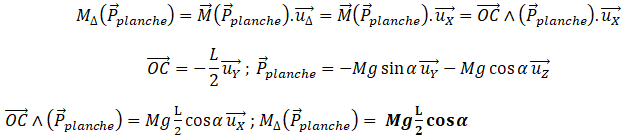Les
oscillateurs de relaxation sont des systèmes qui oscillent indéfiniment
et périodiquement entre
deux états d’énergie différente. Leur évolution n’est pas sinusoïdale
et nécessite une source
extérieure d’énergie. Dans ce problème nous étudions des exemples
d’oscillateurs de relaxation
dans des contextes physiques très différents. Les exercices proposés
sont complètement
indépendants.
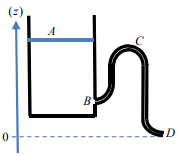
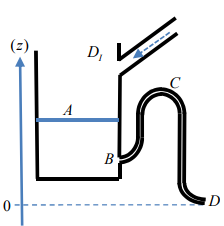
1. La bascule à eau : un oscillateur de relaxation mécanique.
Le système ci-dessous constitue un premier exemple d’oscillateur de relaxation. Un robinet alimente
régulièrement un récipient posé sur le côté droit d’une balançoire initialement inclinée à gauche
(schéma A). Le poids de l’eau finit par faire basculer la planche (schéma B) et le récipient se déverse
sur la droite (schéma C), puis remonte et retrouve sa position initiale A. Dans cet exercice nous
allons déterminer à quelle condition un tel basculement est possible.
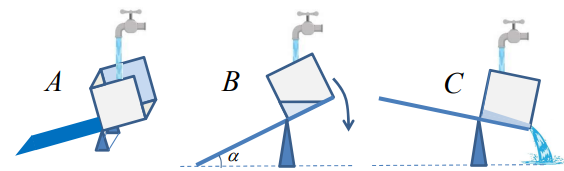
La bascule est constituée d’une planche rectangulaire homogène de masse M , de largeur L et de
longueur 3L . Cette planche est initialement inclinée d’un angle
a par rapport à l’horizontale. Elle
peut pivoter sans frottement autour d’un axe horizontal
D parallèle à son petit côté et passant aux
2/3 de sa longueur (schéma ci-dessous). Le récipient a la forme d’un cube de côté L (ouvert sur le
haut et sur le côté droit). Sa masse est négligeable.
1.1 Exprimer le moment du poids de la planche par rapport à l’axe
D en fonction
de M, g, L et
a , dans la position A. On conviendra que l’axe
D est orienté vers le lecteur,
c'est-à-dire dans la direction ( X ) du schéma ci-dessous.
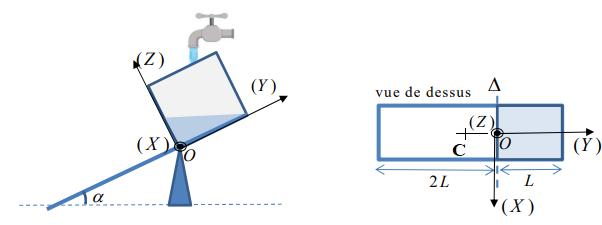
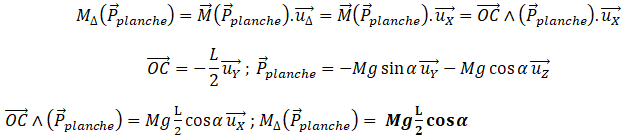
Cette valeur étant positive, le poids fait tourner la planche dans le sens trigonométrique direct.
On suppose pour l’instant que l’eau est montée jusqu’au bord droit du cube sans que la planche ne
pivote, comme indiqué sur le schéma.
1.2. Exprimer la masse m
tot de l’eau contenue dans le récipient en fonction de sa masse
volumique
r , de L et de
a .
Aire de base =½L
2 tan
a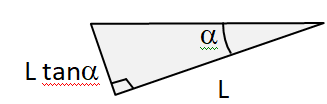
Volume d'eau V =
½L3 tan a.
Masse d'eau: mtot = ½ r L3 tan a.
1.3. Soit G le centre de masse de l’eau contenue dans le récipient à cet instant. Définir G. On
ne demande pas de calculer explicitement ses coordonnées.
On admet que dans le repère orthonormé direct lié à la planche de la balançoire
(voir schéma ci-dessus), les coordonnées de G valent X
G=0, YG = L/3 ; ZG = L / 3 tan
a.
Le centre de masse d'un corps est un point imaginaire de référence situé à la position moyenne de la masse du corps.
1.4. Exprimer en fonction de m
tot , g et
a les coordonnées dans ce même repère du
vecteur P
eau
poids de l’eau dans le récipient. En déduire le moment du poids
de l’eau par rapport à l’axe de rotation
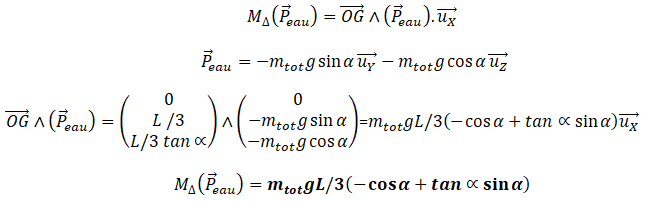 1.5.
1.5. En déduire qu’une première condition nécessaire pour le basculement de la planche est
que
a < 45° . En donner une interprétation géométrique simple. Cette condition étant
remplie, quelle est la valeur maximale M
max de la masse M de la planche qui autorise un
basculement au cours du remplissage du réservoir ? Calculer M
max pour :
a= 30° ,
r=1,0 10
3 kg m
-3 et L =50 cm .
Le moment du poids de l'eau doit être négatif pour provoquer le basculement.
-cos
a + tan
a sin
a < 0 ;
cos a > sin2 a / cos a ; cos2 a > sin2 a ; a < 45° .
La valeur absolue moment du poids de l'eau doit de plus être supérieur au moment de la planche.
mtot g L / 3 ( cos a -tan a sin a) > Mg L / 2 cos a ;
mtot / 3 ( 1 -tan2 a ) > M / 2 ;
½ r L3 tan a / 3 (1 -tan2 a ) > M / 2 ;
r L3 tan a / 3 ( 1 -tan2 a ) > M ;
1,0 103 x0,53 tan 30 / 3(1 -tan230) > M ; M < 16 kg.
2. Le geyser : un oscillateur de relaxation en thermodynamique.
Un geyser est constitué d’une cavité souterraine de volume V
située approximativement à une profondeur h sous la surface
terrestre, à laquelle il est relié par un conduit. Le tout est rempli
d’eau liquide, de masse volumique
r= 1,00 . kg / L supposée
ici indépendante de la température et de la pression. La
température de surface vaut T
0= 300 K et le gradient
géothermique vaut
g=1,00° . C m
-1 (i.e. la température de la roche et de l’eau du geyser augmente
de 1°C lorsqu’on descend de 1 mètre). La pression atmosphérique vaut P
0=1,013 10
5 Pa. On
admet que la vapeur d’eau, même saturante, se comporte ici comme un gaz parfait. La masse
molaire de l’eau vaut M=18,0 g / mol.
2.1. Donner l’allure de la courbe de saturation associée à l’équilibre liquide vapeur dans le
diagramme (P,V). Placer le point critique C' et les domaines d’existence du liquide, de la
vapeur, et du mélange liquide vapeur. Représenter sur ce graphique une isotherme à
une température T inférieure à la température critique. Qu’appelle-t-on pression de
vapeur saturante à la température T ? Que vaut la pression de vapeur saturante de l’eau
à T =100 °C ?
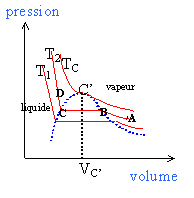
La courbe en pointillés est
appelée courbe de saturation, lle se compose de 2
parties:
- courbe d'ébullition pour V<
VC'.
-courbe de rosée pour
V>VC'.
Au point critique C' les deux
branches se raccordent.
La pression de vapeur saturante est la pression à laquelle la phase
gazeuse d'une substance est en équilibre avec sa phase liquide à
une température donnée. L
a pression de vapeur saturante de l’eau
à T =100 °C vaut 1,013 105 Pa.
2.2. Dans la suite on verra que h est de l’ordre de 200 mètres. Déterminer la pression
correspondante P(h) dans la cavité, l’eau dans le geyser étant liquide et immobile. Si de
la vapeur se forme dans la cavité, quel est son volume molaire v
G ? Comparer le volume
molaire v
L de l’eau liquide à celui du gaz v
G.
Une mole d'eau ( 18 g) occupe un volume molaire vL = 18 mL.
P(h) = P
atm +
rgh.
v
G = RT / P(h) avec T = 300 + h.
v
G = 8,31(300+h)/ (
Patm + rgh).
Si h = 100 m : vG =8,31 x 400 /(1,013 105 +1000 x9,81 x100)=3,07 10-3 m3 >> vL.
Si h = 10 m : vG =8,31 x 310 /(1,013 105 +1000 x9,81 x10)=1,3 10-2 m3 >> vL.
On admet que l’enthalpie de vaporisation (ou chaleur latente) L obéit à l’équation de Clapeyron : L=T(v
G-v
L) dP
v sat /dT . Dans cette expression, P
v sat ,
est la pression de vapeur saturante, qui ne
dépend que de la température T . Dans la suite on néglige v
L devant v
G , et on considère L
comme une constante.
2.3. Montrer qu’avec les approximations faites, l’expression
, P
v sat(T) =A exp(-L/ (RT) est solution de
l’équation de Clapeyron, où A est une constante.
L=T vG dPv sat /dT ; dPv sat /dT =L / (T vG) ; vG = RT / Pv sat pour une mole.
dPv sat /dT =L Pv sat/ (RT2 ) ; dPv sat / Pv sat= L / R dT / T2;
Intégrer : ln(Pv sat) = -L/(RT)+ Cste ; Pv sat =A exp(-L/ (RT).
On rappelle que la température d’ébullition de l’eau vaut
, 373 K à la pression atmosphérique
P
0
. On mesure L= 40,0 kJ mol
-1 .
2.4. En déduire la valeur numérique de la constante A avec trois chiffres significatifs (vérifier
que A est proche de 4 10
10 Pa).
A =
P0
exp(L/ (RT) = 1,013 105 exp(40,0 103 /(8,314 x373)= 4,05 1010 Pa.
Sur le graphe ci-dessous on a représenté la pression de vapeur saturante et la pression hydrostatique
(en Pascal) en fonction de la
profondeur (en mètres).
Dans le cas d’un geyser,
l’ébullition se produit d’abord
dans la cavité (ce qui explique la
grande quantité de vapeur
formée). On note H la
profondeur à laquelle la
pression P de l’eau dans la
cavité coïncide avec la pression
de vapeur saturante P
v sat ,
à la
température imposée par le
gradient géothermique.
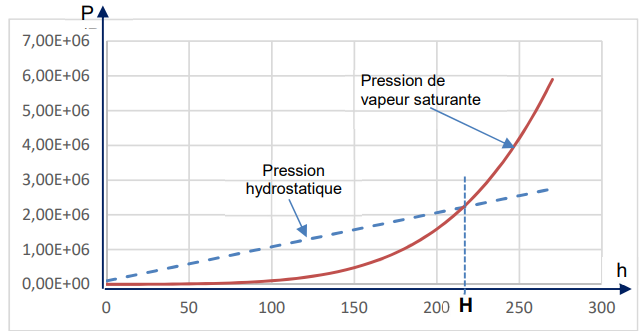 2.5.
2.5. Comparer la profondeur h de la cavité du Geyser à H . Justifier.
Lorsque la pression de l'eau dans la cavité est égale à la pression de vapeur saturante, l'eau se vaporise : h = H.
Pour une profondeur
comprise entre 0 et H , le potentiel chimique µ
V
de l’eau vapeur est-il inférieur ou
supérieur à celui µ
L
de l’eau liquide ? Ecrire l’équation permettant en principe de calculer
H . La solution numérique de cette équation est H = 217 m.
Pour une profondeur
comprise entre 0 et H ,l'eau est sous forme liquide : µ
L > µ
V.
A l'état d'équilibre, l'égalité des potentiels chimiques conduit à :
µ
L(T) = µ
G(T) + RT ln( P
sat / P°).
Pour le liquide :
P(h) = Patm + rgh.
Pour la vapeur : Pv sat =A exp(-L/ (RT).
Patm + rgh = A exp(-L/ (RT).
Dans la suite on supposera que la profondeur h de la cavité vaut exactement H . Dès le début de
l’ébullition dans la cavité, les bulles remontent dans le conduit et expulsent rapidement l’eau qui s’y
trouvait. Le conduit ne contient alors quasiment plus que de la vapeur d’eau et de l’air, et la pression
dans la cavité passe subitement à la pression atmosphérique, alors que la température T de l’eau
y est encore égale à celle de la roche environnante. Cette situation éloignée de l’équilibre conduit à
une intensification soudaine de l’ébullition de toute l’eau de la cavité. On note c =4,18 J K
-1 g
-1 la
capacité thermique massique de l’eau liquide, supposée indépendante de la température, m la
masse d’eau contenue dans la cavité, et m
V
la masse de vapeur produite à chaque éruption du
geyser. On mesure m
V =44,0 10
3 kg. On néglige tout transfert de chaleur avec la roche pendant
l’éruption. Pour déterminer m, on admet que l’on peut appliquer la relation approximative suivante :
mcDT +nV L=0
où n
V est la quantité de matière de vapeur formée et
,
DT = Téb atm-Tgéo(h)
représente l’écart de température de l’eau liquide entre sa valeur initiale dans la cavité et la
température d’ébullition à la pression atmosphérique.
2.6. Proposer une interprétation simple de cette relation. En déduire la masse m et le volume
V de la cavité.
L'énergie libérée par l'eau liquide sert uniquement à vaporiser le liquide : le système, l'eau liquide, est adiabatique.
m =
-nV L/ (cDT) ; DT = Téb atm-Tgéo(H) = 373 -(373+217)= -217 K.
L=4,00 104 J / mol ; nV = 44,0 103 / M(H2O) = 2,44 106 mol.
m = 2,44 106 x4,00 104 /(4,18 103 x217)=1,08 105 kg.
Volume de la cavité : m / reau =1,08 105 / 1000 = 108 m3.
2.7. On assimile la cavité à une sphère et on suppose qu’après éruption du geyser, la cavité
se remplit rapidement avec de l’eau froide à la température T
f=300 K qui se mélange à
l’eau chaude restante. Quelle est la température de l’eau dans la cavité juste après le
remplissage ? Qu’est-ce qui détermine essentiellement la période d’éruption ?
Masse d'eau chaude restante à la température de 517 K : m-m
V =1,08 10
5-4,40 10
4=6,38 10
4 kg.
Volume de cette eau :
6,38 104 / 1000 = 63,8 m3.
Volume d'eau froide à 300 K : 108-63,8 =44,2 m3 ( 4,42 104 kg).
Energie cédée par l'eau chaude : 6,38 104 c ( Tfin -517).
Energie gagnée par l'eau froide : 4,42 104 c ( Tfin -300).
6,38 104 c ( Tfin -517) +4,42 104 c ( Tfin -300)=0
6,38 ( Tfin -517) +4,42 ( Tfin -300)=0.
10,8 Tfin -3,30 103 -1,326 103 =0 ; Tfin =428 K.
La période du cycle d'éruption est déterminée par la durée d'élévation de la température de l'eau froide de 300 K à 517 K.