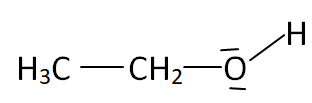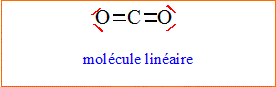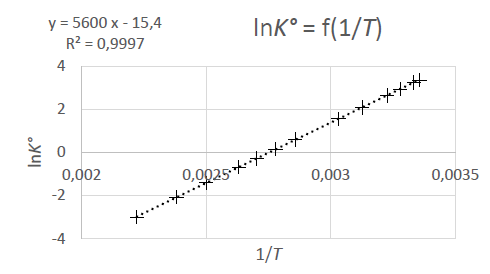Chimie,
élaboration du whisky, concours G2E ( Géologie, Eau, Environnement
)2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Partie 1 : Le maltage et la fermentation
alcoolique.
Le maltage constitue la première étape du processus d’élaboration du
whisky.
L’orge récoltée est mise à tremper dans une cuve afin d’atteindre un
taux d’humidité de plus de 40%.
Cette étape va permettre la germination de l’orge. L’éclosion de
l’embryon provoque la désintégration de la coquille et libère une
enzyme, la diastase, qui va permettre la transformation des amidons en
sucres. L’orge, devenue du malt vert, est alors mise à sécher en
présence de tourbe ou dans des fours diffusant de l’air chaud. À
l’issue de l’étape du maltage, le malt concassé est brassé en présence
d’eau dans une cuve en acier afin d’extraire ses sucres. On obtient
ainsi, après
filtration, le « wort », un liquidé sucré. Vient ensuite l’étape de
fermentation alcoolique. Des levures apportant une enzyme, la zymase,
sont ajoutées au malt dans des cuves en bois, appelées « washbacks ».
Le glucose est alors progressivement transformé en éthanol et en
dioxyde de carbone selon l’équation suivante :
C6H12O6(aq) = 2 C2H5OH(aq)
+ 2 CO2(g)
1. Donner les
formules de Lewis de l’éthanol et du dioxyde de carbone. Prévoir la
géométrie autour de l’atome de carbone dans la molécule de dioxyde de
carbone selon la méthode VSEPR.
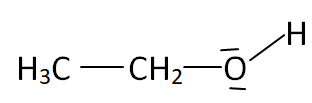
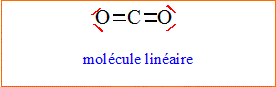 L'atome
de
carbone central est du type AX2.
2.
Préciser le rôle de l’enzyme dans l’étape de
fermentation alcoolique. Illustrer son rôle schématiquement à l’aide du
dessin d’un profil réactionnel. L'atome
de
carbone central est du type AX2.
2.
Préciser le rôle de l’enzyme dans l’étape de
fermentation alcoolique. Illustrer son rôle schématiquement à l’aide du
dessin d’un profil réactionnel.
L'enzyme catalyse la transformation du glucose en éthanol.
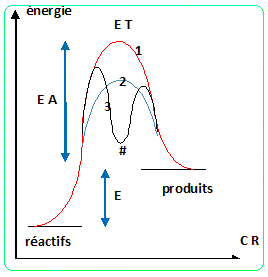
|
E T : état de transition ; CR : coordonnée
réactionnelle
EA : énergie d'activation ; E : énergie de la
réaction
# : intermédiaire réactionnel
(1) : absence de catalyseur
(2) : catalyse avec stabilisation de l'état de
transition
(3) : catalyse avec remplacement d'une réaction
lente par deux réactions plus rapides.
|
Partie 2 : Synthèse industrielle de
l’éthanol.
L’éthanol peut être également produit à partir d’éthène gazeux mis en
présence de vapeur d’eau, en catalyse acide, selon l’équation de
réaction suivante :
C 2H 4(g) + H 2O(g) = C 2H 5OH(g)
La constante d’équilibre thermodynamique de cette réaction sera notée
K°.
On représente ci-dessous des graphiques représentant diverses fonctions
donnant l’évolution de K° avec la température.
3. Déterminer la
variance du système. Commenter.
La variance est le nombre de paramètres intensifs indépendants.
La règle des phases donne la variance d'un système thermodynamique : v = c+2-j.
Le chiffre 2 indique le nombre de paramètres intensifs, température et
pression.
c : nombre de constituants indépendants ( nombre de constituants - nombre de
réactions chimiques indépendantes entre ces constituants)
Nombre de constituants : c=3 ; nombre de relation : 1 ; nombre de phase :
j=1, une seule phase gazeuse.
v = c-1+2-j= 3-1+2-1 =3.
L'opérateur peut choisir 3 paramètres intensifs indépendants les uns des autres ( température, pression, fractions molaires).
4. Dans le cadre de l’approximation d’Ellingham, déterminer les valeurs
de l’enthalpie standard et de l’entropie standard de réaction. Vous
expliciterez votre démarche.
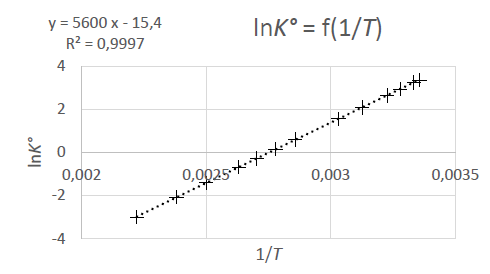 DrG°T
=DrH°T -T DrS°T.
DrG°T
=DrH°T -T DrS°T.
DrG°T
= -RT ln(KT) ; ln(KT) = -DrH°T / (RT) +1/R DrS°T = 5600 / T -15,4.
-DrH°T / R = 5600 ; DrH°T =-5600 x 8,314= -4,66 104 J mol-1.
DrS°T =-15,4 R = -15,4 x8,314 = -128 J mol-1 K-1.
5. Rappeler la loi de Van’t Hoff et montrer qu’elle permet de justifier
l’évolution de K° avec la température.
d ln(K) /dT = DrH°/(RT2).
ln(K) = -DrH°/ T par intégration.
ln(K) est une fonction linéaire croissante avec 1 / T.
6. On considère un système à l’équilibre. Étudier l’influence de la
pression totale à température et composition constantes.
Le nombre de mole diminue ( 2 moles de réactifs et une mole de
produit). La réaction est favorisée ( déplacement de l'équilibre
dans le sens direct ) par une augmentation de pression à température et
composition constantes.
Industriellement, la réaction a lieu à 523 K et à 70 bars. On
considèrera, pour les questions suivantes, que la constante d’équilibre
thermodynamique vaut K° = 9,07.10 –3 à 523 K. Les réactifs sont introduits en proportions stoechiométriques. On définit le taux d’avancement a de la réaction comme le rapport de la quantité (en mol) d’éthanol formé par la quantité initiale (en mol) d’éthène.
7. Déterminer la valeur du taux d’avancement à l’équilibre.
|
avancement (mol)
|
C2H4(g) |
+ H2O(g) |
= C2H5OH(g) |
initial
|
0
|
n
|
n
|
0
|
équilibre
|
x
|
n-x
|
n-x
|
x
|
Nombre total de mol : 2n-x
Pressions partielles : P(éthanol) = x P / (2n-x).
P(éthène) = P(eau) = (n-x) P / (2n-x).
K° = P(éthanol) / (P(éthène) P(eau))= x (2n-x)/ [(n-x)2P].
K° =x/n (2n/x-1)/ [(n/x-1)2P].
a=x / n ; K° =a (2-a)/ [(a-1)2P] ; K°(a-1)2P=a (2-a).
9,07 10-3 x 70 (a-1)2=a (2-a).
0,635 (a2+1-2a)=2a-a2.
1,635 a2-3,27 a+0,635=0. Discriminant D =3,272 -4 x1,635 x0,635 =6,54=2,562.
a =(3,27 -2,56) / (2x1,635)~0,22.
Les valeurs du taux d’avancement a en fonction de la température pour une pression de 70 bars sont représentées ci-dessous
T(K)
|
293
|
373
|
423
|
473
|
573
|
623
|
a (%)
|
98
|
86
|
67
|
42
|
11
|
5
|
8. Expliquer le choix de température et de pression fait par les industriels.
La
température proche de 523 K est défavorable à l'équilibre, mais il faut
que les espèces soient gazeuse sous une pression de 70 bars.
Une pression élevée déplace l'équilibre dans le sens direct.
|
...
|
....
|
Partie 3 : Distillation du wash.
Après l’étape de fermentation alcoolique, le liquide obtenu, le wash,
est acheminé vers des alambics afin de procéder à sa distillation. Ce
mélange présente un degré alcoolique d’environ 10°, correspondant à une
fraction molaire en éthanol xéthanol = 0,05. L’objectif de la distillation est d’obtenir
un degré alcoolique de 70°, correspondant à une fraction molaire xéthanol = 0,42.
Les alambics utilisés pour la distillation des « single malts »
écossais sont de type pot still. Ils sont en cuivre et s’achèvent par
un col de cygne lui-même relié à un condenseur. Ils ne réalisent que
des distillations simples. Le whisky écossais est obtenu après une
double distillation, c’est-àdire après le passage par un dispositif où
deux alambics sont branchés en série.
9. Préciser le
nombre et la nature des phases dans les différents domaines I, II, III
et IV et nommer les courbes 1 et 2 du diagramme binaire.
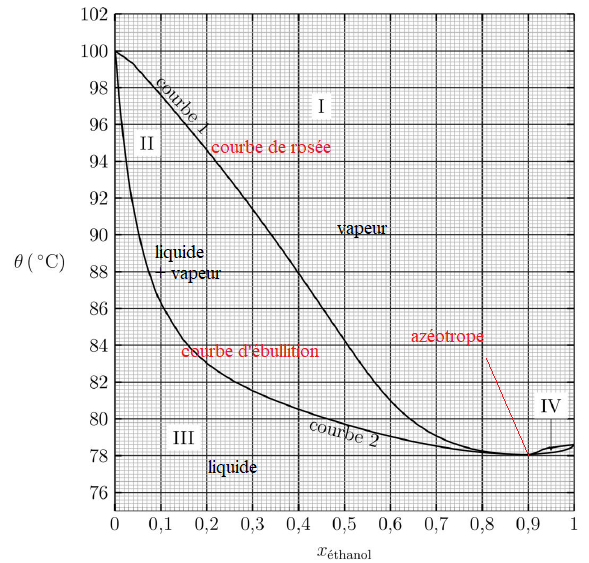
10. Nommer le
mélange correspondant à xéthanol = 0,90 et indiquer la propriété de ce
mélange lors de la transition de phase liquide-vapeur.
Le mélange azéotrope bout à une température fixe. La phase vapeur
possède la même composition que la phase liquide avec laquelle elle est
en équilibre.
11. On chauffe un
mélange contenant une fraction molaire en éthanol de 0,05. Représenter
l’allure de la courbe d’analyse thermique isobare correspondante en
justifiant. Faire de même pour un mélange à xéthanol = 0,90.
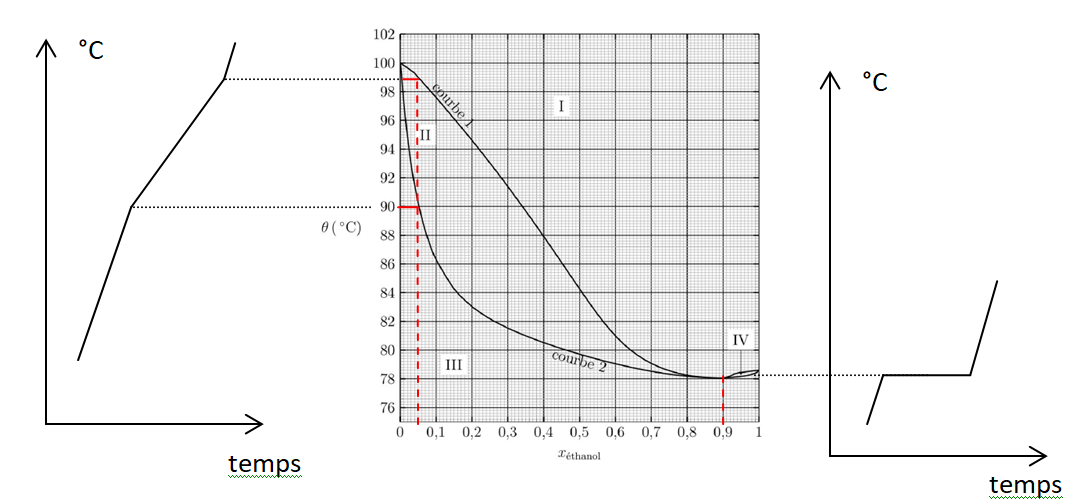
12. En vous
appuyant sur une construction graphique réalisée sur le document
réponse 1, déterminer la fraction molaire maximale en éthanol que
présente le
liquide à la sortie du dispositif à deux alambics.
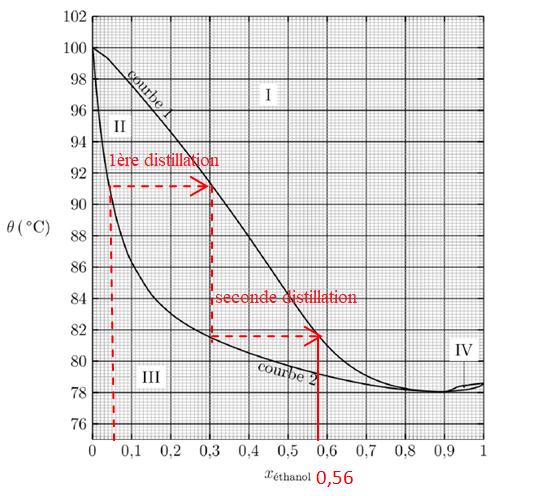
13. En réalité, le liquide recueilli en sortie du dispositif de double distillation présente une teneur en éthanol xéthanol = 0,42. Proposer une explication à la différence observée.
Si dans le condenseur l'eau de refroidissement est trop chaude, la totalité des vapeurs n'est pas condensée ( perte d'alcool).
Si dans
le condenseur l'eau de refroidissement est trop froide, on observe unn
reflux des vapeurs dans le col de cygne ( perte d'alcool).
14.
Indiquer le pourcentage d’éthanol qui serait obtenu après une
distillation fractionnée du même mélange qu’à la question précédente.
La distillation fractionnée conduit au mélange azéotropique : xéthanol = 0,9.
Partie 4 : Dosage de l’éthanol dans le whisky.
Avant toute commercialisation du whisky, il est indispensable de
déterminer le degré alcoolique du whisky. Ce dernier est défini comme
le volume d’éthanol pur en mL contenu dans 100 mL de whisky, à une
température de 20°C. Un whisky ne peut être commercialisé que si son
degré alcoolique est supérieur à 40°. On se propose de vérifier ce
dernier en réalisant le dosage de l’éthanol.
On supposera dans cette partie la température constante et égale à 20°C.
Principe du dosage de l’éthanol.
Le dosage par titrage de l’éthanol est réalisé par oxydation de l’éthanol par un excès de dichromate de potassium (2K+, Cr2O72–) en milieu acide.
L’excès d’ions dichromate est ensuite dosé par une solution aqueuse contenant des ions Fe2+ obtenue par dissolution de sel de Mohr dont la formule est FeSO4,(NH4)2SO4,6H2O.
Le repérage de l’équivalence est obtenu en utilisant un indicateur coloré, le diphénylamine sulfonate de baryum.
Protocole de titrage.
Dans un erlenmeyer de 250 mL, on introduit successivement :
- V0 = 10,0 mL de solution aqueuse de whisky diluée 500 fois
- V1 = 20,0 mL de solution aqueuse de dichromate de potassium à la concentration C1 = 2,00. 10−2mol. L−1
- 10 mL d’acide sulfurique concentré.
On laisse sous agitation pendant 30 minutes.
On introduit dans la burette une solution aqueuse de sel de Mohr à la concentration CFe = 1,00. 10−1mol. L−1.
On ajoute quelques gouttes d’indicateur coloré dans l’erlenmeyer puis
on réalise le titrage. L’équivalence est obtenue pour un volume de
solution de sel de Mohr versé Ve = 18,2 mL.
On donne le diagramme potentiel-pH de l’élément chrome (en traits
pleins). On superpose sur ce diagramme le diagramme potentiel-pH en
solution aqueuse relatif à l’acide éthanoïque, l’ion éthanoate et
l’éthanol (en pointillés). Les concentrations de tracé sont toutes
prises égales à 1,0 mol.L–1.
15. Attribuer les domaines de prédominance A, B et C aux espèces correspondantes.
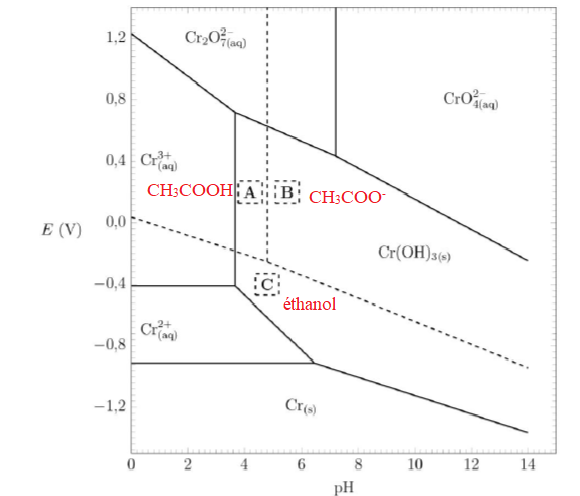
16. Retrouver l’équation de la frontière séparant les domaines A et C.
CH3CH2OH +H2O--> CH3COOH + 4e- +4H+.
E = E°( CH3COOH /CH3CH2OH )+0,06 / 4 log([CH3COOH) [H+ ]4 / [CH3CH2OH]).
Sur la frontière : E = E°( CH3COOH /CH3CH2OH )+0,06 / 4 log( [H+ ]4 ).
E = E°( CH3COOH /CH3CH2OH )-0,06 pH.
17. Déterminer l’équation de la réaction ayant lieu lors de l’ajout de l’excès de dichromate de potassium K2Cr2O7 à l’éthanol en présence d’acide sulfurique. Justifier la réponse à l’aide du diagramme potentiel-pH.
L'éthanol et l'ion dichromate appartiennent à des domaines disjoints. L'éthanol est donc oxydé.
3 fois {
C2H5OH
+H2O =
CH3COOH +
4H+ + 4e-
}
oxydation alcool
2 fois {
Cr2O72-
+ 14H+ + 6e-
= 2Cr3+ + 7
H2O
} réduction de l'ion
dichromate
3C2H5OH
+ 2Cr2O72-
+16H+=
3CH3COOH + 4Cr3+ + 11
H2O
(1)
18.
Proposer un protocole, en 15 lignes maximum, permettant la préparation
de 1,00 L de solution diluée 500 fois de Whisky. On précisera la
verrerie utilisée.
Prélever 1000 / 500 = 2,0 mL de rhum à
l'aide d'une pipette jaugée + pipeteur.
Placer dans une fiole jaugée de 1,00 L et
compléter avec de l'eau distillée jusqu'au
trait de jauge.
Agiter pour rendre homogène.
19. Écrire l’équation de la réaction support du titrage.
Dosage de l'ion dichromate en
excès :
6 fois {
Fe2+ = Fe3+
+e- }
oxydation de l'ion fer
II
Cr2O72-
+ 14H+ + 6e-
= 2Cr3+ + 7
H2O
Cr2O72-
+6Fe2+
+14H+ = 6Fe3++
2Cr3+ + 7
H2O
(2)
20. Déterminer la quantité (en mol) de Cr2O72– introduite initialement n(Cr2O72-)i et la quantité (en mol) de Cr2O72–en excès n(Cr2O72–)ex.
n(Cr2O72-)i = V1C1 =20 x2,0 10-2 =0,40 mmol.
A l'équivalence : n(Fe(II)) =CFe Ve = 0,10 x 18,2 = 1,82 mmol.
n(Cr2O72-)dosé =n(Fe(II)) / 6 =0,303 mmol.
n(Cr2O72–)réagi avec éthanol=0,40 -0,303=0,097 mmol.
21. Calculer la concentration en éthanol dans le whisky, notée CEt, en mol.L–1.
n(éthanol) = 1,5 n(Cr2O72-)réagi avec éthanol =1,5 x0,097 =0,146 mmol dans 10 mL de whisky.
[éthanol] = 0,146 / 10 = 0,0146 mol / L.
Tenir compte de la dilution : 0,0146 x500 =7,28 mol / L.
22. Déterminer le
degré alcoolique du whisky étudié puis indiquer si le whisky est
conforme aux normes de commercialisation. On donne la densité de
l’éthanol à 20°C : d = 0,790.
Masse d'éthanol : 7,28 M(éthanol) = 7,28 x 46,0 =335 g / L.
Volume d'éthanol : 335 / 0,79 =424 mL
Volume d’éthanol pur en mL contenu dans 100 mL de whisky : 42,4 mL
Degré du whisky : 42,4° > 40 °, donc commercialisable.
|
|