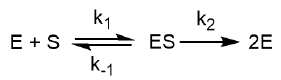Chimie,
étude de la méthanisation, concours G2E ( Géologie, Eau, Environnement
)2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Etude
de la méthanisation.
On
propose dans ce problème d’étudier le processus de méthanisation. Il
s’agit de convertir de la biomasse, c’est-à-dire des déchets
organiques, en composés valorisables tels que le méthane ou le
dihydrogène. Les déchets organiques utilisés sont très divers : eaux
usées, boues de station d’épuration, déjections animales. Cette
transformation, réalisée dans un méthaniseur, nécessite le
développement de bactéries afin de permettre aux différentes réactions
chimiques de se dérouler. La méthanisation se déroule en quatre étapes
principales : l’hydrolyse, l’acidogénèse, l’acétatogénèse et la
méthanogénèse.
Partie 1 : Étude des
réactions en solution aqueuse dans le méthaniseur.
Les réactions ayant lieu dans le méthaniseur font intervenir de
nombreuses espèces acido-basiques tels que l’acide éthanoïque (CH3COOH),
l’acide propanoïque (C2H5COOH) ou encore l’acide
butanoïque (C3H7COOH).
Ces acides sont nommés Acides Gras Volatils (AGV) et sont issus de
l’étape d’acidogénèse. Il convient de pouvoir contrôler la
concentration de ces AGV. En effet, un excès d’AGV entrainerait des
baisses de pH ce qui pourrait conduire à inhiber l’action des
bactéries. Afin d’éviter cela, on utilise une solution équimolaire en
ions hydrogénocarbonate (HCO3−) et en
dihydrogénocarbonate (H2CO3) comme solution
tampon.
1. Dresser le
diagramme de prédominance associé aux espèces H2CO3,
HCO3− et CO32−. Donner le
qualificatif associé à l’espèce HCO3−.

HCO3− se
comporte en acide ou en base, cette espèce est amphotère.
2.
Expliciter le rôle et les propriétés d’une solution tampon. Justifier
que la solution dans le méthaniseur est une solution tampon.
Une solution tampon modère les variations de pH suite à l'ajout d'un
acide ou d'une base, suite à une dilution modérée.
On utilise une solution
équimolaire en ions hydrogénocarbonate (HCO3−) et
en dihydrogénocarbonate (H2CO3) pH voisin de pKa1
=6,37.
3.
Calculer le pH au sein du méthaniseur, puis déterminer sous quelle
forme est l’acide butanoïque dans le méthaniseur.
pH =pKa1 =6,37.
Acide butanoïque / ion butanoate pKa = 4,9.
A pH > 6,37, l'acide butanoïque est majoritairement sous forme d'ion
butanoate.
La solubilité du butanoate de
sodium (C3H7COONa) dans l’eau pure est de 22 g∙L-1.
Dans le méthaniseur on observe que la concentration en ion sodium est
d’environ 0,04 mol∙L-1 et que celle en forme majoritaire de
l’acide butanoïque est d’environ 0,01 mol∙L-1.
4. Déterminer si
le butanoate de sodium solide est présent dans le méthaniseur.
M(C3H7COONa)=
110 g / mol ; solubilité =22 / 110 = 0,2 mol / L.
Cette valeur est supérieure à 0,01 mol/ L. Le butanoate de sodium solide
n'est pâs présent dans le méthaniseur.
Partie 2 : Étude
thermodynamique de la méthanisation.
La production de méthane repose en particulier sur les réactions
listées dans le tableau ci-dessous. Ces réactions sont assurées par des
enzymes mais seuls les aspects thermodynamiques sont étudiés ici.
L’utilisation d’enzymes impose de contrôler la température du
méthaniseur : on la prend constante et égale à 313 K. Le dihydrogène
joue un rôle particulier puisqu’il est produit par certaines réactions
et consommé par d’autres. L’objectif de cette partie est de montrer
qu’il n’est possible de produire du méthane que dans une certaine gamme
de pression partielle en dihydrogène.
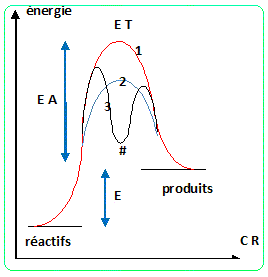
5. Mettre en
évidence l’effet catalytique des enzymes en représentant le profil
réactionnel d’une réaction modèle se déroulant avec et sans enzyme.
Préciser si les enzymes ont une influence sur les caractéristiques
thermodynamiques de la réaction.
|
E T : état de transition ; CR : coordonnée
réactionnelle
EA : énergie d'activation ; E : énergie de la
réaction
# : intermédiaire réactionnel
(1) : absence de catalyseur
(2) : catalyse avec stabilisation de l'état de
transition
(3) : catalyse avec remplacement d'une réaction
lente par deux réactions plus rapides.
|
6.
On étudie la réaction 1 qui produit des ions éthanoate à partir
d’éthanol.
CH3CH2OH(aq)+2H2O(l)=CH3COO-aq+2H2(g)+H3O+aq.(1)
a) À partir des
données, calculer l’enthalpie standard de réaction et l’entropie
standard de réaction associées à la réaction 1. Commenter le signe de
l’entropie standard de réaction.
DH =DfH°(CH3COO-aq)+2
DfH°(H2(g)+DfH°(H3O+aq)-DfH°(CH3CH2OH(aq)-2DfH°(H2O(l)).
DH = -486-285,6+277,6+2 x 285,6
=77,2 kJ/mol.
DS =S°(CH3COO-aq)+2 S°(H2(g)+S°(H3O+aq)-S°(CH3CH2OH(aq)-2S°(H2O(l)).
DS =86,6+2 x130,7 +70 -160,7-2
x70=117,3 J mol-1 K-1.
L'entropie augmente, la transformation est irréversible. Le désordre
augmente, le nombre d'espèces dans les produits est supérieur au nombre
d'espèces dans les réactifs.
b)
En déduire la valeur de l’enthalpie libre standard de réaction pour la
réaction 1 se déroulant à 313 K.
DG = DH-TDS =77,2 -313 x 0,1173 ~ 40,5 kJ /
mol.
7. On souhaite
étudier uniquement l’influence de la pression partielle en dihydrogène PH2
sur les équilibres précédents. On considère que les autres espèces
chimiques ont une activité égale à 1. On utilise alors la
représentation dans la figure ci-dessous.
CH3CH2COO-aq + 2 H2O(l) = CH3COO-aq
+3H2(g) +CO2(g) (2).
DG°=+71,67 kJ/mol.
C3H7COO-aq + 3H2O(l) = 2CH3COO-aq
+2H2(g) +H3O+aq(3). DG°=+48,1 kJ/mol.
4H2(g) + HCO3-aq +H3O+aq= CH4(g)
+4H2O(l). (4)
DG°=-135,6 kJ/mol.
a) Exprimer l’enthalpie libre de
réaction DrGi
pour les réactions 1 à 4 en fonction de PH2, T, R, P° et de
l’enthalpie libre standard DrG°i de la réaction correspondante.
DrG1 =DrG°1+RT ln(
P2H2/ P0).
DrG2 =DrG°2+RT ln(
P3H2 PCO2 / P0).
DrG3 =DrG°3+RT ln(
P2H2/ P0).
DrG4 =DrG°4+RT ln(
1/ P4H2/ P0).
b)
Attribuer les différentes droites obliques du diagramme donné aux
équations précédentes.
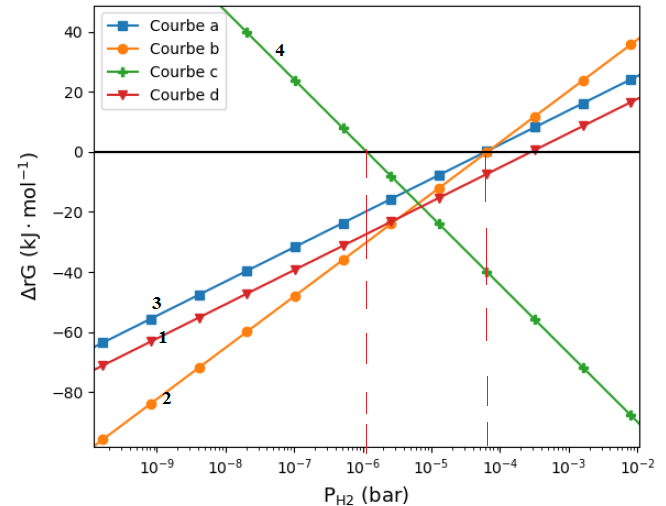
c) Préciser
l’utilité et la signification de la droite horizontale.
La droite horizontale correspond à l'équilibre chimique.
Pour que la méthanisation puisse avoir lieu et que le réacteur
fonctionne en régime permanent, on considère qu’il faut imposer une
pression partielle en dihydrogène telle que chacune des quatre
réactions se produise dans le sens direct.
8. Préciser l’intervalle de pression partielle en dihydrogène
pour que le méthaniseur fonctionne en régime permanent.
Les enthalpies libres doivent être négatives.
[10-6 bar ; 5 10-5 bar].
9. Discuter de
l’impact environnemental que peut présenter un méthaniseur en termes de
pollution et de risques.
Avantages
: valorisation de la biomasse directement sur le territoire. Le gaz
vert est une énergie renouvelable.
Réduction des gaz à effet de serre, le méthane n'est pas rejeté dans
l'atmosphère.
La matière organique sert ensuitede fetilisants organiques, substituts
des engrais chimiques.
Inconvénients
: investissement élevé au départ et coûts d'entretien.
Risque de pollution des sols et des eaux si le procédé de méthanisation
est mal réalisé.
Odeurs, trafic routier plus dense, impact sur le paysage.
Utilisation du mais dans le méthaniseur au détriment de l'alimentation.
Partie 3 : Valorisation du
méthane par combustion.
On modélise la matière première injectée dans le méthaniseur par de
l’amidon de formule brute (C6H10O5)n
. La réaction globale associée à la méthanisation est alors :
(C6H10O5)n (aq) + n H2O (liq) =
3n CO2 (g) + 3n CH4 (g) (5)
On considère que l’eau est en excès. Le méthane produit peut être
utilisé comme combustible. La réaction modélisant la combustion du
méthane est la suivante :
CH4 (g) + 2 O2 (g) = CO2 (g) + 2 H2O
(liq) (6)
L’enthalpie standard de la réaction de combustion vaut : D𝑟𝐻°=− 890 kJ∙mol-1.
10. Déterminer la
masse d’amidon nécessaire pour produire la quantité de méthane
permettant, par sa combustion, d’amener 250 mL d’eau initialement à
20°C à ébullition. Préciser les approximations effectuées lors de ce
calcul.
Energie nécessaire poue porter l'eau de 20°C à 100°C, l'eau restant
liquide.
Q = mcDq =0,25 x 4180 x
80=8,36 104 J= 83,6 kJ.
En supposant que l'énergie fournie par la combustion du méthane serve
uniquement à chauffer l'eau :
83,6 / 890 ~0,094 mol de méthane.
0,094 / (3n) = 0,031 / n mol d'amidon.
M(amidon) =(6 x12+10+5x16)n=162 n g / mol.
Masse d'amidon : 0,031 / n x 162 n ~5,1 g.
Partie 4 : Étude de la
cinétique bactérienne lors de la méthanisation.
Dans cette partie, on s’intéresse à la cinétique associée au
développement des bactéries et on se propose d’étudier le modèle de J.
Monod. On notera par S le substrat disponible pour la croissance et par
E la bactérie étudiée. On suppose alors que le mécanisme de croissance
suit les étapes suivantes :
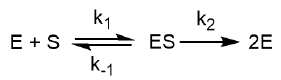
ES est un complexe entre la bactérie et son substrat. On peut
comprendre ce mécanisme en le comparant au modèle de Mickaelis-Menten,
à ceci près que le produit formé est la bactérie elle-même.
11. Exprimer la
vitesse de disparition du substrat S en fonction des vitesses des
étapes élémentaires.
d[S] / dt = -k1[S][E]+k-1[ES]
12. En appliquant
l’AEQS au complexe ES, montrer que la vitesse de disparition du
substrat S est égale à la vitesse de l’étape 2.
d[ES] / dt =k1[S][E]-k-1[ES]-k2[ES]
=0 (A)
d[S] / dt = -k2[ES]
On admettra que la conservation
de la quantité totale de matière s’écrit à tout instant :
[E] + [S] +2[ES] =[N]0
avec [N]0 une constante que l’on considère comme un
paramètre du problème.
13. Montrer que
[ES]=([N]0[S]−[S]2)/ (2[𝑆]+KM) en
précisant l’expression de KM en fonction des constantes
cinétiques des étapes du mécanisme proposé.
[E] =[[N]0 -[S] -2[ES].
Repport dans (A) : k1[S] ([N]0 -[S] -2[ES])=(k-1+k2)
[ES].
(2k1[S]+ k-1+k2)
[ES] = k1[S] ([N]0 -[S])=k1( [S][N]0 -[S]2).
[ES] =k1( [S][N]0 -[S]2) / (2k1[S]+ k-1+k2) =( [S][N]0 -[S]2) / [2[S]+ (k-1+k2)/k1].
KM = (k-1+k2)
/ k1.
14.
En déduire l’expression de la vitesse de disparition du substrat S en
fonction de k2, [N]0, [S] et KM.
d[S] / dt = -k2[ES]=-k2(([N]0[S]−[S]2)/
(2[𝑆]+KM).
On définit [B] la totalité de la biomasse présente dans le milieu comme
[B]=[E]+2[ES]. Il est possible de suivre expérimentalement l’évolution
temporelle de [B] dans le milieu réactionnel. En définissant la
grandeur 𝑈=1/[B]x d[B]dt, et en se servant de l’expression de la
vitesse de disparition du substrat, un développement théorique non
détaillé ici permet d’arriver à la relation : 1/ U=2 / k2+ KM
/ k2 x 1/[S]
L’étude de bactéries décomposant l’acide acétique a été menée. La
concentration initiale en acide acétique, qui est le substrat, est de
1,568 g∙L-1. Le tracé de 1/ U=𝑓(1/[S]) est donné
ci-dessous. Les points expérimentaux ont été modélisés par une relation
affine du type y=a x +b qui est tracé sur le même graphique.
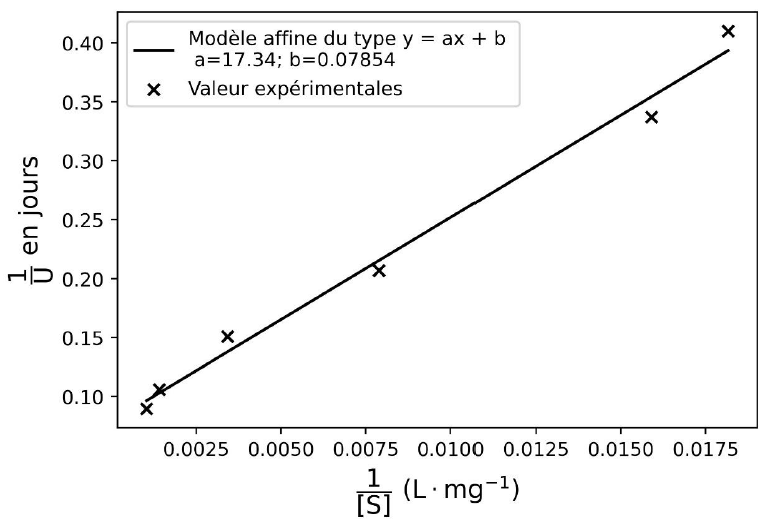
La valeur de k2 peut être reliée, dans le cadre de ce modèle
et en début de croissance uniquement, au temps de doublement des
bactéries TD grâce à la relation : TD=2 ln2 / k2
.
Cette relation nécessite l’approximation : KM << 2[S]
15. Estimer au bout
de combien de temps on peut considérer que la quantité de bactérie
utilisée a doublé.
Ordonnée à l'origine b =0,07854 =2 / k2 ; k2 = 2 / 0,07854
=25,46.
TD = 2 ln(2) / 25,46 =0,0544 jour.
16.
Évaluer la validité de l’approximation réalisée (un argument numérique
est attendu dans la réponse), puis critiquer le résultat obtenu à la
question précédente.
KM / k2
= 17,34 ; KM =17,34 x25,46~441.
L’approximation : KM
<< 2[S] n'est pas vérifiée.
|
...
|
....
|
Partie 5 : Étude de
la synthèse d’hydroxylamides.
Les hydroxylamides sont des composés très utilisés en chimie de par
leur capacité à créer des complexes métalliques qui possèdent une
couleur intense, ce qui justifie leur utilisation en chimie analytique.
Cette partie étudie tout d’abord la synthèse organique de la fonction
hydroxylamide avant de s’intéresser en particulier à la synthèse de la
Tépoxaline, un anti-inflammatoire.
Synthèse de la fonction
hydroxylamide.
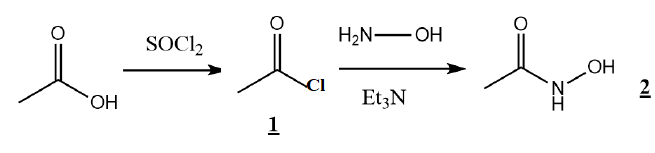
La fonction hydroxylamide peut être synthétisée à partir d’un acide
carboxylique et de l’hydroxylamine suivant la séquence réactionnelle
présentée ci-dessous.
17. Donner la
structure du composé 1.
18. Identifier le
problème que l’on rencontre lorsqu’on réalise la synthèse d’un amide à
partir d’un acide carboxylique et d’une amine, puis justifier la
stratégie de synthèse mise en oeuvre pour synthétiser l’hydroxylamide 2.
A partir
d’un acide carboxylique et d’une amine, il y a un échange de proton entre l'acide
et la base.
L'acide doit se trouver sous une forme activée ( chlorure d'acyle ou
anhydride d'acide).
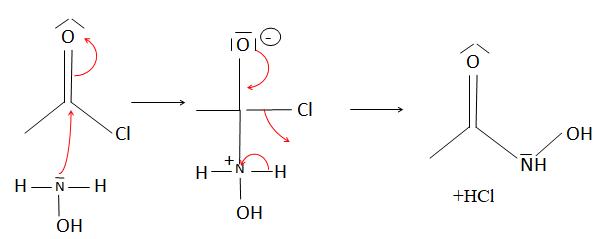
19. Par analogie
avec la synthèse d’un amide, proposer un mécanisme pour la
transformation du composé 1 en composé 2.
20. On peut
également synthétiser des hydroxylamides à partir d’ester.
Proposer une voie de synthèse (réactifs, conditions expérimentales,
montage…) de l’éthanoate de méthyle à partir de l’acide éthanoïque
permettant d’obtenir l’ester avec un bon rendement.
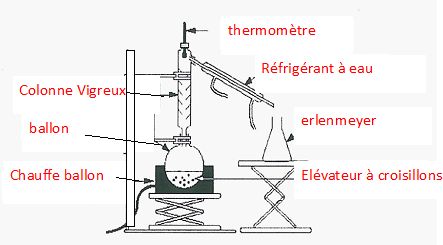
On peut utiliser l'un des réactifs en grand excès ou éliminer le
produit le plus volatil ( ici l'ester Téb = 57 °C) au fur et
à mesure qu'il se forme.
Synthèse de la Tépoxaline.
On étudie la synthèse de la Tépoxaline selon la voie développée par
Murray & Coll détaillée ci-après :
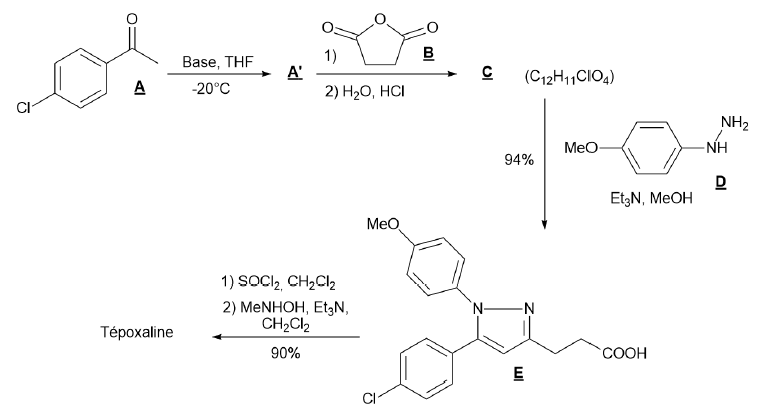
21. Justifier que
le composé A présente un H acide. Proposer alors une structure pour le
composé ionique A’ ainsi qu’une base adaptée pour son obtention.
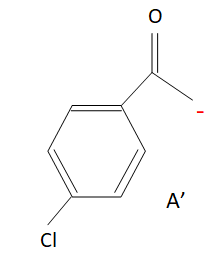
Un hydrogène situé en a
d'un groupe carbonyle est acide.
Bases : pyridine, triéthylamine, alcoolate.
22. On étudie
l’obtention du composé C à partir du composé A’ et de
l’anhydride succinique B. Par analogie avec la réaction de Claisen,
déterminer la structure du composé C et proposer un mécanisme pour sa
formation.
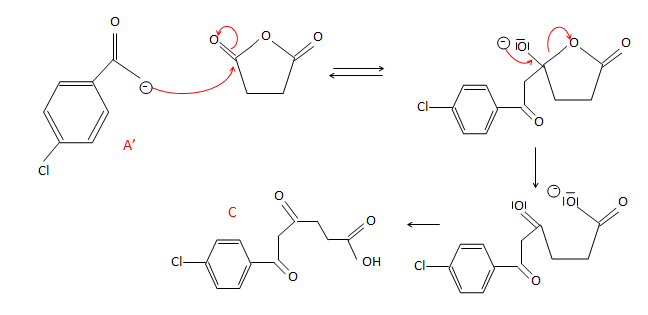
23. Justifier que
l’anhydride succinique B soit ajouté après la base
utilisée pour former A’. On argumentera la réponse à l’aide de la
structure de sous-produits potentiels.
24. Le composé C
est siège d’équilibres céto-énoliques. Le spectre RMN
du composé C, réalisé dans CDCl3, est donné ci-dessous. On
indique
qu’en RMN les noyaux d’hydrogène portés par des groupes hydroxyle
conduisent à des signaux peu visibles.
Signal
|
Déplacement
chimique (ppm)
|
Forme
|
Intégration
|
1
|
2,7
|
Multiplet
( mal résolu)
|
2H+2H
protons a et b
|
2
|
6,1
|
Singulet
|
1
H proton c ( forme ènol)
|
3
|
7,5
|
non
fournie
|
2
H protons du cycle aromatique
|
4
|
7,9
|
non
fournie
|
2H
protons du cycle aromatique |
a) Montrer que le
spectre RMN indique que le composé C se trouve majoritairement sous une
forme énol que l’on dessinera.
Si la forme ß dicétone était majoritaire, le signal c intègrerait
pour 2 protons.
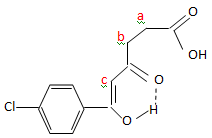
b) Attribuer les
signaux du spectre RMN à la forme énol proposée.
c) Expliquer
pourquoi la forme énol du composé C est majoritaire.
La double liaison de la forme ènol est conjuguée avec les liaisons
doubles du cycle aromatique.
Le réactif D, utilisé pour la formation du composé E, peut être obtenu
selon la séquence réactionnelle suivante :
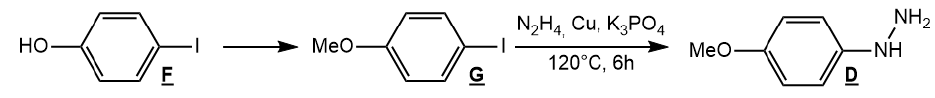
25. Proposer des
conditions opératoires pour synthétiser le composé G à partir du
composé F et donner le mécanisme associé à la réaction proposée.
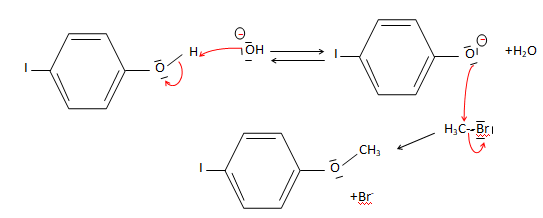
Solvant aprotique ( DMSO, DMF).
Les deux étapes de transformation du composé A en composé C mettent en
jeu 19,3 g de composé A, 5,0 g de composé B et 125 mmol de la base
choisie par les auteurs de la synthèse. Un total de 10,8 g de composé C
est obtenu.
M(A)=154,59 g/mol ; M(B)=100,07 g / mol ; M(C)=254,67 g / mol.
26. À l’aide de
l’ensemble des informations contenues dans cette partie, calculer le
rendement global de la synthèse de la Tépoxaline depuis le composé A.
n(A) =19,3 / 154,59=0,1248 mol ; n(B) =5,0 / 100,07=0,4965 mol ( en
excès) ;
n(C théorique ) =0,1248 mol ; n(C réel) =10,8 / 254,67 =0,0424 mol.
Rendement de cette étape : 0,0424 / 0,1248=0,334.
Rendement global : 0,334 x 0,94 x 0,90 ~ 0,29.
Partie 6: Titrage des AGV
par la méthode de Montgoméry.
Complexation des hydroxylamides par les ions fer III
En ce qui concerne la méthanisation, une des méthodes développées pour
analyser la quantité d’acides gras volatils (AGV) au sein du
méthaniseur est la méthode de Montgoméry qui repose sur l’utilisation
des hydroxylamides synthétisées dans la partie précédente.
L’acétatohydroxylamide AHA est un ligand qui peut former des complexes
métalliques en présence de fer. La coordination des complexes est
3:1. La réaction associée à la formation du complexe est : Fe3+(aq)
+ 3 AHA (aq) = [Fe(AHA)3]3+(aq)
La constante thermodynamique de cette réaction est notée β et vaut 1028.
27. Déterminer la
configuration électronique du fer (Z = 26) et de l’ion Fe3+.
Configuration
électronique de l’atome de fer ( Z=26) dans son état fondamental : 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
Fe3+ 1s2 2s2 2p6 3s2 3p6 3d5 (
la couche 3d5 est
à moitié pleine).
28. On ajoute 1,0.10-3
mol d’acétatohydoxylamide à 10 mL de chlorure de fer III à la
concentration de 5,0 mol.L-1. Déterminer la composition de
l’état d’équilibre.
|
avancement
(mmol)
|
Fe3+(aq) |
+ 3
AHA (aq) |
=
[Fe(AHA)3]3+(aq) |
initial
|
0
|
50
|
1,0
|
0
|
à l'équilibre
|
x
|
50-x
|
1-3x
|
x
|
1
/ 3
|
~
50
|
~
0
|
1
/ 3
|
L'ion Fe3+ est
en large excès et la constante thermodynamique est grande : 1-3x ~0 ; x
~1 /3 mmol.
Application à la
méthode de Montgoméry
On donne ci-dessous le protocole pour appliquer la méthode de
Montgoméry afin de déterminer la concentration en acides gras volatils
(acide éthanoïque, propanoïque ou butanoïque).
Étape 1 :
Clarifier l’échantillon par filtration ou centrifugation.
Étape 2 :
Prélever V0
= 0,5 mL du liquide et l’introduire dans un tube à essai sec. Ajouter
1,5 mL d’éthan-1,2-diol et 0,2 mL d’acide sulfurique dilué à 8,9 mol /
L. Chauffer pendant trois minutes puis immédiatement refroidir à l’aide
d’eau froide.
Étape 3 :
Ajouter 0,50 mL de sulfate d’hydroxylammonium à 0,6 mol / L et 2,0 mL
d’hydroxyde de sodium à 4,5 mol / L.
Étape 4 :
Verser V1
= 10 mL de chlorure de fer (III) à 0,07 mol / L préparé dans une
solution d’acide sulfurique à 0,356 mol / L dans une fiole jaugée de 25
mL. Y ajouter ensuite le contenu du tube à essai et compléter au trait
de jauge avec de l’eau distillée. Mesurer l’absorbance de la solution à
l’aide d’une cuve de 4 cm de large.
On modélisera tous les acides gras volatils comme étant de l’acide
éthanoïque. On négligera leurs propriétés acido-basiques. L’analyse
d’un échantillon à l’aide du protocole décrit précédemment aboutit à
une absorbance de 0,44.
L’étape 1 permet de convertir l’acide éthanoïque en ester en présence
d’éthan-1,2-diol, introduit en excès. L’étape 2 permet d’obtenir la
fonction hydroxylamide à partir de l’ester précédent. On suppose que
les transformations chimiques réalisées lors de ces étapes sont
totales. Le fer introduit dans la dernière étape est en excès.
29. Rappeler la loi
de Beer-Lambert en précisant ses hypothèses.
A = e l c.
A absorbance ; e :
coefficient d'absorption molaire L mol-1 cm-1 ; l
: largeur de la cuve en cm ; c : concentration du soluté en mol /
L.
Cette loi est valable pour les faibles concentrations et pour des
absorbances inférieures à 1.
30. On note C la
concentration en quantité de matière d’acide éthanoïque dans
l’échantillon de l’étape 1. Exprimer C’ la concentration en quantité de
matière de complexe obtenu à l’issue de l’étape 4 en fonction de C et
des volumes pertinents.
n(acide éthanoïque)initial = C V0 mmol ;
n(Fe3+) = 0,07 V1 mmol en excès.
Volume de la fiole jaugée (étape 4) = 25 mL.
n(complexe) = 25 C' mmol.
CV0 = 3 x 25 C' ; C' = CV0 / 75 =0,5 C /
75 = 6,67 10-3C .
La procédure de Montgoméry
appliquée à des solutions étalons de complexe [Fe(AHA)3]3+
donne les résultats suivants :
Solution
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
[Fe(AHA)3]3+(mol / L) |
2,5
10-5
|
5,0
10-5 |
7,5
10-5 |
1,0
10-4 |
1,25
10-4 |
1,5
10-4 |
1,75
10-4 |
2,0
10-4 |
Absorbance
|
0,195
|
0,315
|
0,495
|
0,650
|
0,820
|
1,015
|
1,165
|
1,345
|
31. Proposer un
protocole précis pour obtenir 100 mL de la solution 1 à partir de la
solution 4.
Facteur de dilution : 1,0 10-4 / (2,5 10-5) = 4.
Fiole jaugée de 100,0 mL ; prélever 25 ,0 mL de solution 4 à l'aide
d'une pipette jaugée de 25,0 mL. Verser dans la fiole jaugée et
compléter avec de l'eau distillée jusqu'au trait de jauge ; agiter pour
rendre homogène.
Afin de fonctionner correctement, la concentration en AGV dans le
méthaniseur ne doit pas excéder une concentration de 1,7 mmol∙L-1.
32. Déterminer la
concentration en AGV dans l’échantillon testé, puis indiquer si
l’échantillon testé décrit un fonctionnement normal du méthaniseur.
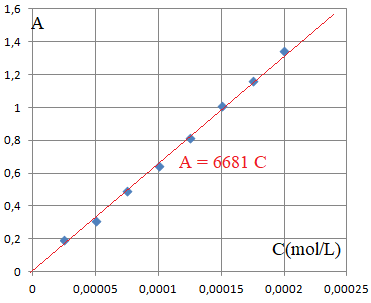
C' = 0,44 / 6681 ~6,6 10-5 mol/L
6,6 10-5 =6,67
10-3C ; C =9,9 10-3
mol / L= 9,9 mmol / L.
|
|