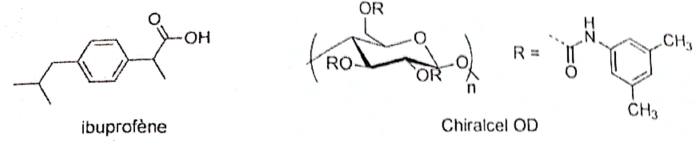
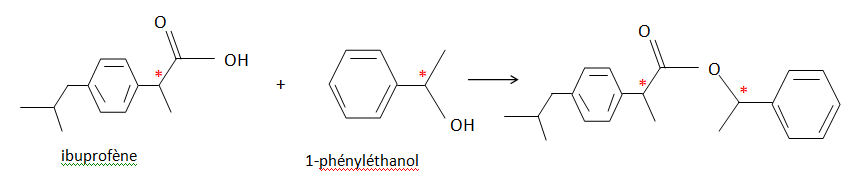
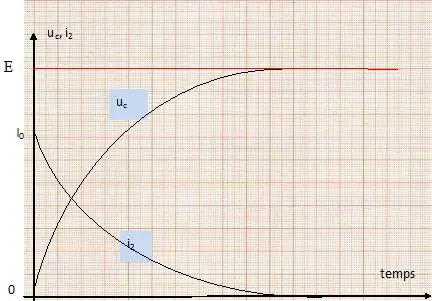
Exercice 1. Atomistique.
1 Associer l'élément chimique à sa famille.
Fluor : halogènes.
Potassium : métaux alcalins.
Argon : gaz rare ( noble).
Calcium : alcalino-terreux.
Sélénium : chalcogènes.
.
Le bore 5B.
2. Quelle est sa configuration électronique ?
1s
2 2s
2 2p
1.
3. Cet atome possède t-il des életrons non appariés ?
Oui, électron 2p
1.
4. Est-il paramagnétique ou diamagnétique ?
Comme il possède un électron non apparié, il est paramagnétique.
5. Quel est le symbole des éléments chimiques qui appartiennent à la même période que le bore ?
Li, Be,
B, C, N, O, F, Ne.
Etude de la molécule de borane.
6. Quels sont les électrons de valence de l'atome de bore ? Proposer un schéma de Lewis pour cette molécule.
Comment appelle -t-on ce type de composés ?
2s2 2p1.
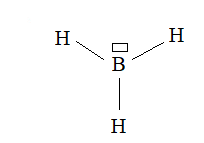
Le borane est un acide de Lewis.
Exercice 2. Projections.
1) Parmi les projections ci-après, laquelle ou lesquelles correspond(ent) à la molécule suivante ?
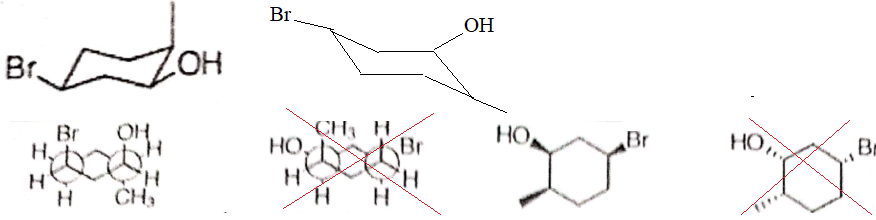
Précisez la configuration absolue de l'atome de carbone portant le groupe OH.
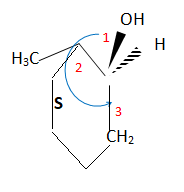
Exercice 3. Chimie organique.
Le schéma de la synthèse de l'acide 2,2-diméthylpent-4-énoïque est décrit :
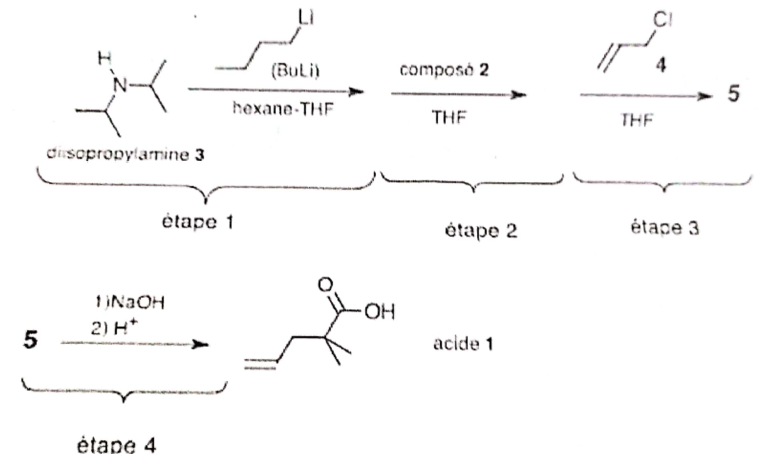 On se propose de déterminer la structure de l'ester 2 ( composé 2), de formule brute C6H12O2. On donne son spectre RMN du proton et son spectre IR ( bande fine vers 1735 cm-1)
1.
On se propose de déterminer la structure de l'ester 2 ( composé 2), de formule brute C6H12O2. On donne son spectre RMN du proton et son spectre IR ( bande fine vers 1735 cm-1)
1. Quel est le nombre d'insaturation de cette molécule ?
(6 x2 +2 -12) /2=1.
2) En quoi le spectre IR confirme la structure de l'ester ?
Bande forte et fine vers 1735 cm
-1 ( liaison C=O)
3. Montrer que la molécule comporte un groupe éthyle CH
2-CH
3 et un groupe isopropyle CH(CH
3)
2.
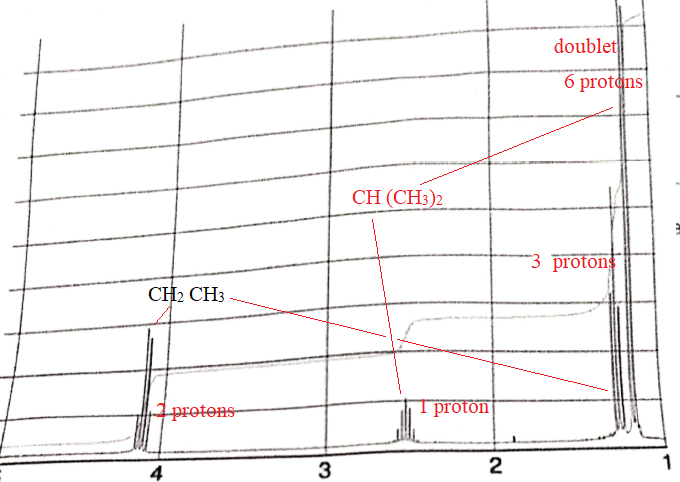 CH2 CH3
CH2 CH3.
Vers 4,1ppm, on observe un quadrulet ( intégrant pour 2 protons) ayant 3 protons sur le carbone voisin.
Vers 1,2 ppm, on observe un triplet ( intégrant pour 3 protons) ayant 2 protons sur le carbone voisin.
CH(CH3)2.
Vers 1,1 ppm, on observe un doublet ( intégrant pour 6 protons ) ayant 1 proton sur le carbone voisin.
Vers 2,5 ppm, on observe un multiplet ( intégrant pour 1 proton ) ayant 6 protons sur le carbone voisin.
4. En déduire la formule topologique de la molécule.
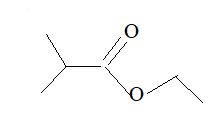 5.
5. Réaction entre un organomagnésien CH
3MgI avec un ester C
6H
5COOCH
2CH
3 puis hydrolyse en milieu acide. Quelle est la réaction de synthèse de l'organomagnésien ?
La réaction de synthèse de l’iodure de méthylmagnésium s’effectue dans l’éther anhydre (ou éthoxyéthane anhydre).
CH3I+Mg --> CH3MgI.
6. Donner le
produit de la réaction sachant qu'elle nécessite l'utilisation d'au
moins 2 équivalents de réactif de l'organomagnésien.
C6H5CH OH CH3
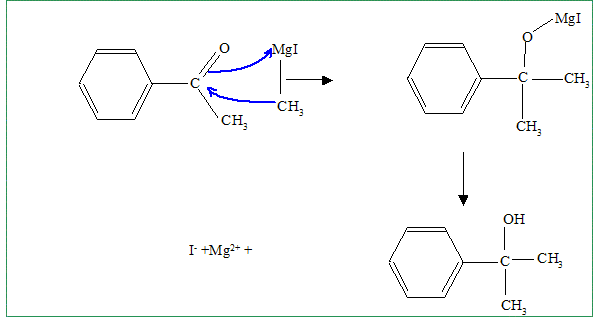
7. Qu'obtient -on si un seul équivalent de réactif de l'organomagnésien est mis en jeu ?
C6H5CO CH3
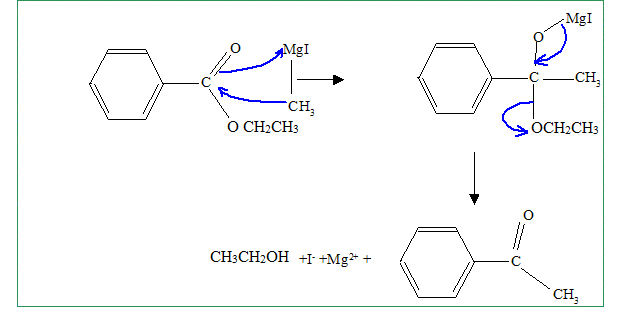
8. Donner le mécanisme avec deux équivalents de réactif de l'organomagnésien.
 9.
9. Préciser les conditions expérimentales.
Il
faut travailler en milieu anhydre, sinon l'organomagnésien est détruit
par l'eau ( la réaction est vive); de plus l'éther, par ses propriétés
basiques, stabilise l'organomagnésien formé.
Exercice 4. Oxydo-réduction.
L'eau de Javel est fabriquée par action de dichlore gazeux sur une solution d'hydroxyde de sodium.
1. Quelles sont les deux demi-équations correspondantes ?
Cl
2(g) +2e
- = 2Cl
-aq.
Cl
2(g) + 4HO
-aq = 2ClO
-aq + 2H
2O
+2e- .
2. En déduireune équation de la réaction avec comme seuls réactifs Cl
2(g) et H
2O.
2Cl2(g) + 2H2O = 2ClO-aq +2Cl-aq +4H+aq.
3. Quelle est l'équation de la réaction entre les ions oxonium et les ions hydroxyde ?
4H+aq + 4HO-aq --> 4H2O.
4. Quelle est l'équation chimique de synthèse de l'eau de Javel ?
2Cl2(g) + 4HO-aq = 2ClO-aq + 2H2O +2Cl-aq .
Exercice 5 Chimie analytique.
A chromatographie généralités.
Soit le chromatogramme ci-dessous où le pic 1 correspond à un composé
non retenu par la phase stationnaire et le pic 2 correspond à un
composé retenu par cette phase.
 1.
1. Expliquer et calculer les grandeurs suivantes :
Le temps mort tM est
le temps mis par un composé non retenu par la phase stationnaire pour
traverser la colonne (temps passé uniquement dans la phase mobile). tM ~3 min.
Le temps de rétention tR est le temps nécessaire à un composé pour éluer de la colonne et être détecté. tR ~ 6 min.
Le temps de rétention réduite du composé 2 : tR' = tR-tM.
2. Déterminer le
facteur de rétention k du composé 2.
k = (
tR-tM) / t
M =3 / 3 = 1.
Si k < 1, l'élution est trop rapide.
Si k > 5, l'élution est trop lente.
3. Donner la formule pour calculer la résolution entre deux pics.
R = 2(t
R2-t
R1) / (I
2-I
1).
t
R : temps de rétention ; I largeur à la base du pic.
Si R >1,5 la séparation est complète.